合成生物企业的合规运营风险探析——以微生物研发为视角
合成生物企业的合规运营风险探析——以微生物研发为视角
一、行业政策与监管体制
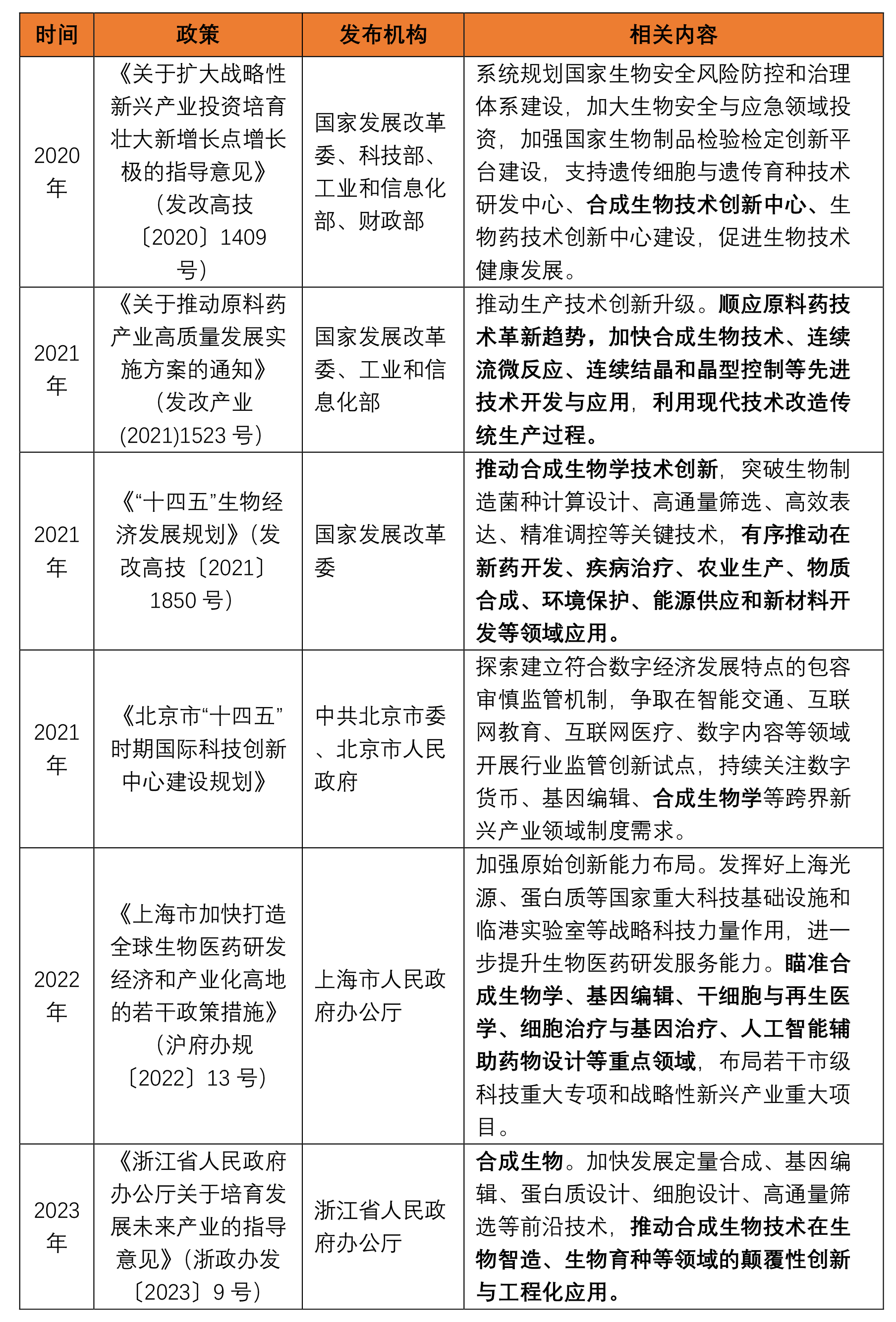
1. 合成生物学之相关政策
合成生物学定义一直众说纷纭。2000年初期,美国斯坦福大学的库尔(E. Kool)在美国化学学会年会上重新提出合成生物学的概念,将其定义为基于系统生物学的遗传工程和工程方法的人工生物系统研究,从基因片段、DNA分子、基因调控网络与信号传导路径到细胞的人工设计与合成。[1]作为一项新型前沿技术,合成生物企业利用可再生的生物质资源为原料研发和生产各种产品,目前在我国已经受到政策的大力支持:
2. 微生物涉及的相关监管体制
微生物是合成生物学的常见研究材料,特别是在各种生物制药、生物制品中,微生物发挥了重要作用。例如,微生物药物在抗感染领域已经具有不可替代的作用,目前临床抗生素中有70%来源于微生物天然产物或微生物天然产物衍生物,拯救了数以亿计的生命。
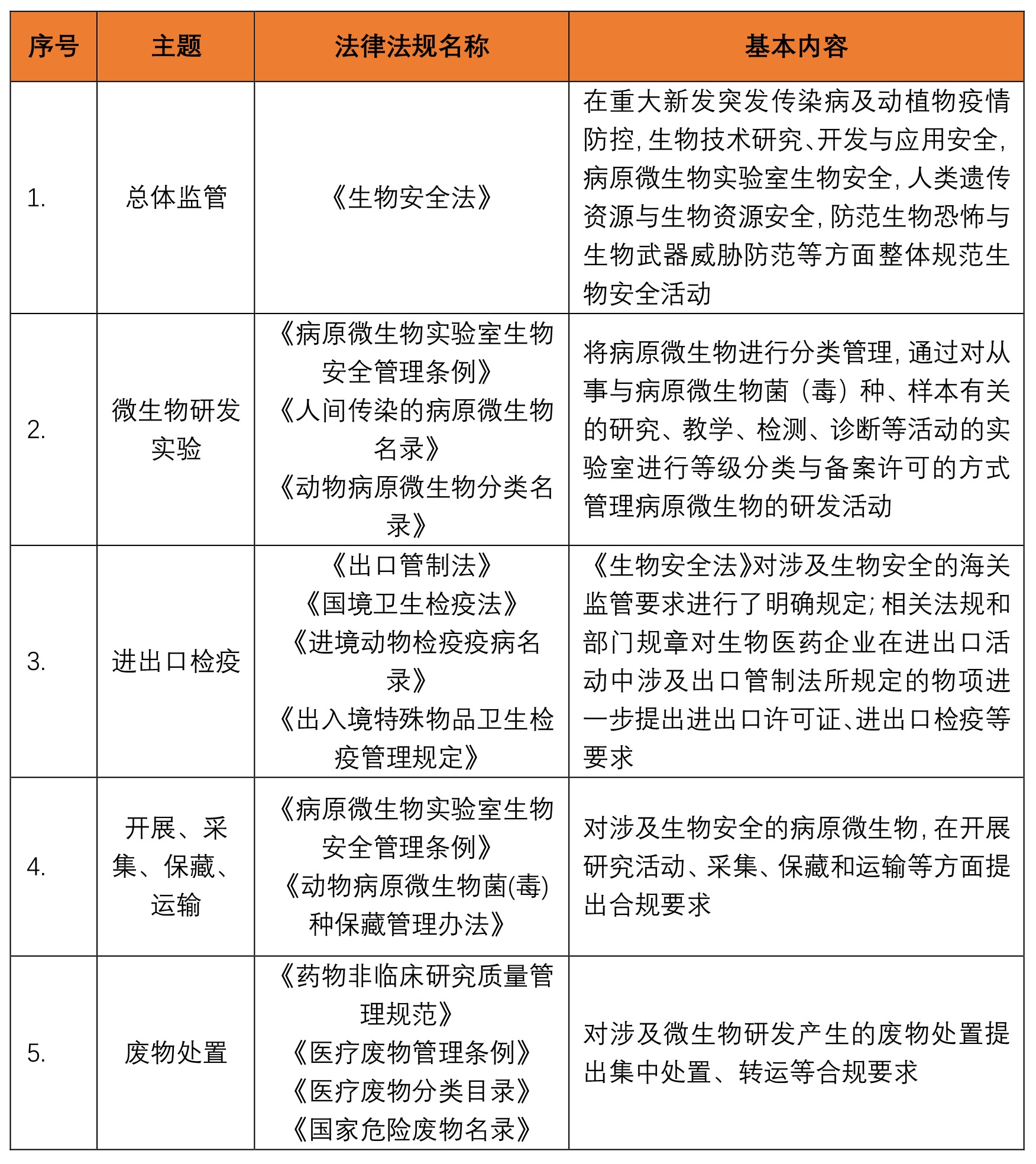
由于微生物在医药领域的突出作用,同时因许多病原微生物会导致人类和动植物引发疾病,就微生物的研发活动及相关的生物安全防控,特别是病原微生物的监管,一直属于生物医药领域规制的重点。我国对微生物研发及相关的生物安全主要通过如下法律法规进行规制:
二、微生物研发涉及的资质和许可
1. 病原微生物实验室备案
根据《生物安全法》和《病原微生物实验室生物安全管理条例》,前述法律法规根据病原微生物的传染性、感染后对个体或者群体的危害程度,将病原微生物分为四类,不同分类等级的病原微生物在研发过程中对实验室的等级备案要求不同,不同等级的微生物实验室对应实验活动范围亦不同,具体如下:
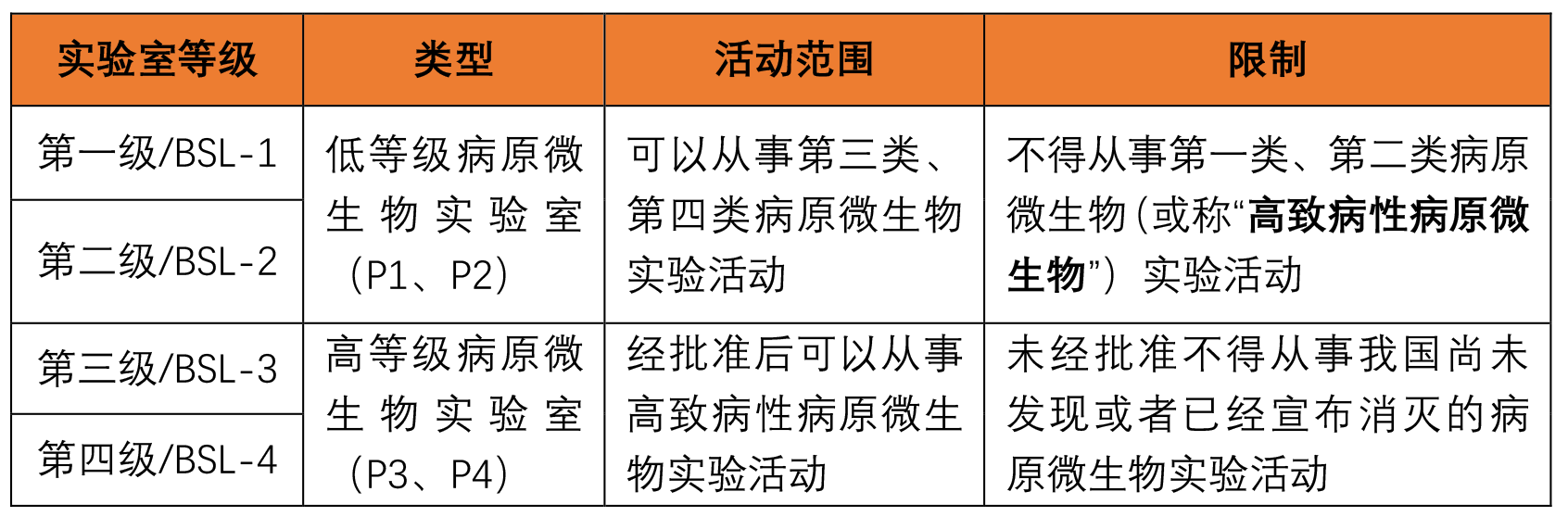
具体病原微生物的等级分类可结合《人间传染的病原微生物名录》和《动物病原微生物分类名录》确定。根据笔者的项目经验,部分合成生物企业对自身涉及的微生物存在的病原性等级了解程度不足,例如常见的铜绿假单胞菌、金黄色葡萄球菌等均属于《人间传染的病原微生物名录》第三类病原微生物,除非感染性材料的实验外,一般应当在经备案的病原微生物实验室(BSL-2及以上等级)进行实验活动;此外,涉及动物、兽药疫苗研发的企业,企业往往忽视了对病原微生物实验室的备案要求,如某企业开展非洲猪瘟病毒检测活动,以二级实验室开展对非洲猪瘟病毒(第一类病原微生物)的实验室检测的行为,违反了《病原微生物实验室生物安全管理条例》第二十一条,被予以行政处罚(杭农(兽药)罚决字[2019]第3号)。
2. 进出口管制与检疫申报
(1)进出口管制
根据《出口管制法》,合成生物企业在进出口活动中使用的药品、病毒试剂等,如涉及《两用物项和技术进出口许可证管理目录》的内容,均应依法办理两用物项和技术进出口许可证[2]。
此外,根据商务部公布的《中国禁止进口限制进口技术目录》(商务部公告2021年第37号),该目录在限制进口技术部分增加了医药制造业的相关内容:“27 医药制造业 编号:212701X;技术名称:高致病病原微生物;控制要点:《中华人民共和国进境动物检疫疫病名录》中第一、二类动物疫病病种名录所限制的内容;《人间传染的病原微生物名录》中第一、二类病原微生物,以及我国尚未发现或者已经宣布消灭的病原微生物。"据此,在高致病病原微生物进出口领域,除对高致病病原微生物本身限制进出口以外,还对进口涉及该等高致病病原微生物的相关技术予以限制。
(2)检疫审批
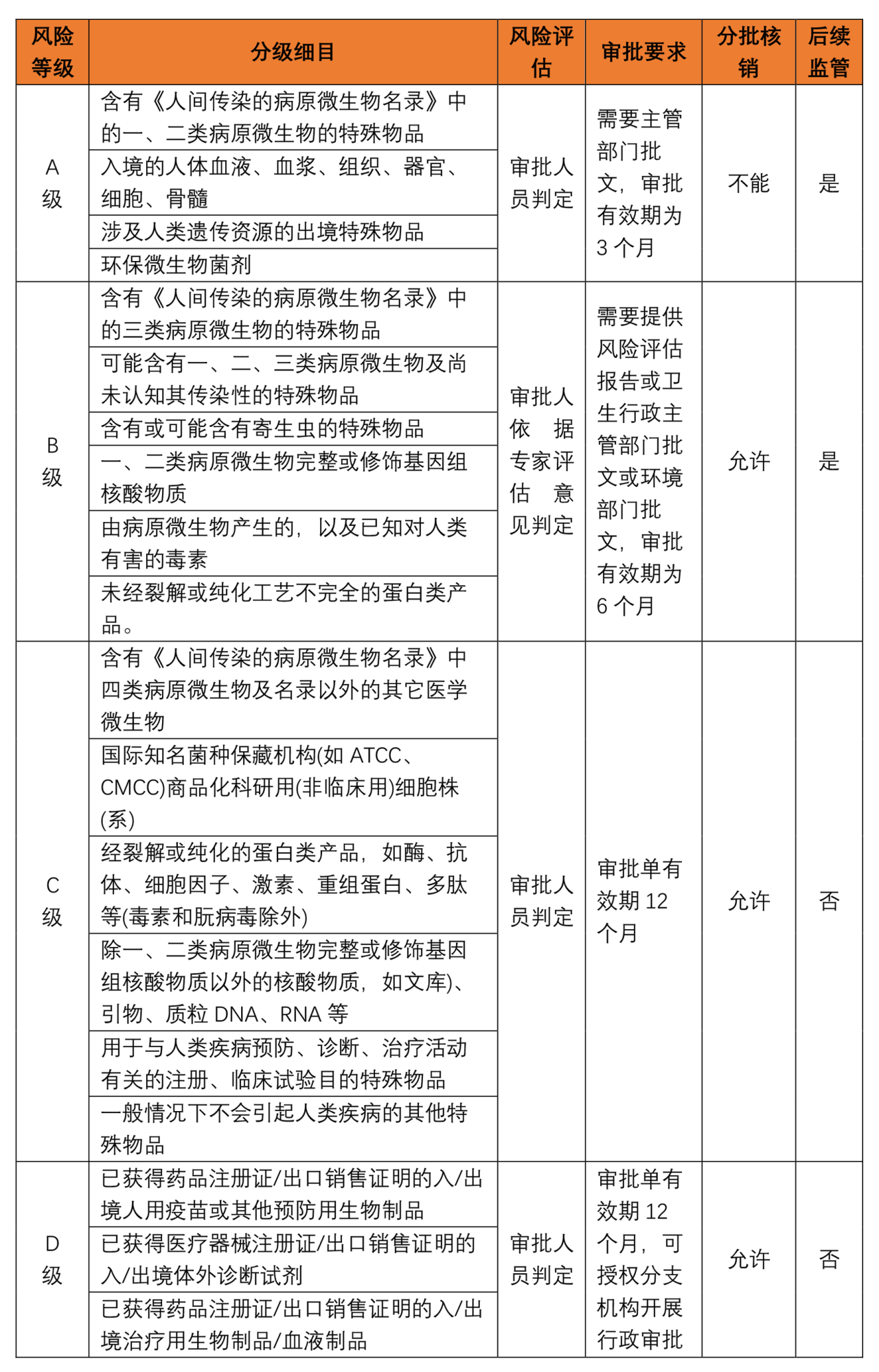
如合成生物企业需从国外进口特定的病原微生物,根据《国境卫生检疫法》《出入境特殊物品卫生检疫管理规定》,微生物进出口属于卫生检疫监督管理的“特殊物品",在进出口环节需要进一步关注检疫审批事项。依据《出入境特殊物品风险管理工作规范(试行)》,国家质量监督检验检疫总局根据特殊物品致病性、致病途径、使用方式和用途以及可控性等风险因素,将特殊物品可划分为A、B、C、D四个级别的风险,具体的《出入境特殊物品风险分级监管表》如下:
3. 人类遗传资源备案
根据《人类遗传资源管理条例》第二条规定:“人类遗传资源材料是指含有人体基因组、基因等遗传物质的器官、组织、细胞等遗传材料"。然而,一般情况下微生物由细菌、真菌和病毒组成;合成生物企业使用的微生物菌种如不含有人类遗传物质,则一般情况下被认定为属于人类遗传资源材料的可能性较小,在合成生物企业进行合成微生物研究时,我们亦建议企业提前比对《人类遗传资源管理条例》的内容进一步确认备案要求。
三、微生物研发过程的合规风险
1. 采购来源之非商业化使用
根据笔者经验,除从国外引进微生物、境内商业化购买外,合成生物企业常见微生物的获取来源还可能是从国际微生物保藏单位[3]进行购买。我国目前拥有三个《国际承认用于专利程序的微生物保存布达佩斯条约》[4](“《布达佩斯条约》")承认的国际微生物保藏单位,即中国典型培养物保藏中心(“CCTCC")、中国微生物菌种保藏管理委员会普通微生物中心(“CGMCC")和广东省微生物菌种保藏中心(“GDMCC")。
但是需要注意的是,CCTCC和CGMCC均在其官网上对产品的用途做了非商业化用途说明,如CCTCC在其订购说明中明确要求[5]:“本中心提供的生物材料,仅可作非营利目的的科学研究之用,不能转让他人或应用于生产,如需用于生产或其它目的,购买方需同本中心签订特别许可转让协议。"CGMCC在其官网发布的《生物材料提供和利用协议书》第3条[6]提到:“购买者利用CGMCC提供的生物材料时,不得侵害研究所或第三方对该生物材料拥有的任何知识产权或其它权利...获得所有必须的知识产权许可,并就商业化开发产生的惠益做出分享安排,是购买者本人应履行的义务。"因此我们建议相关企业在购买前与国际保藏中心进行沟通是否符合相关规定[7]。
据此,合成生物企业如需从国际保藏中心引进微生物,则需要结合最终使用目的与国际保藏单位提前进行沟通,特别是对于以微生物研发相关产品作为主营业务或核心技术的企业,应当避免企业的核心技术出现与外部机构之间的潜在侵权纠纷。
2. 开展、采集、保藏、运输相关要求
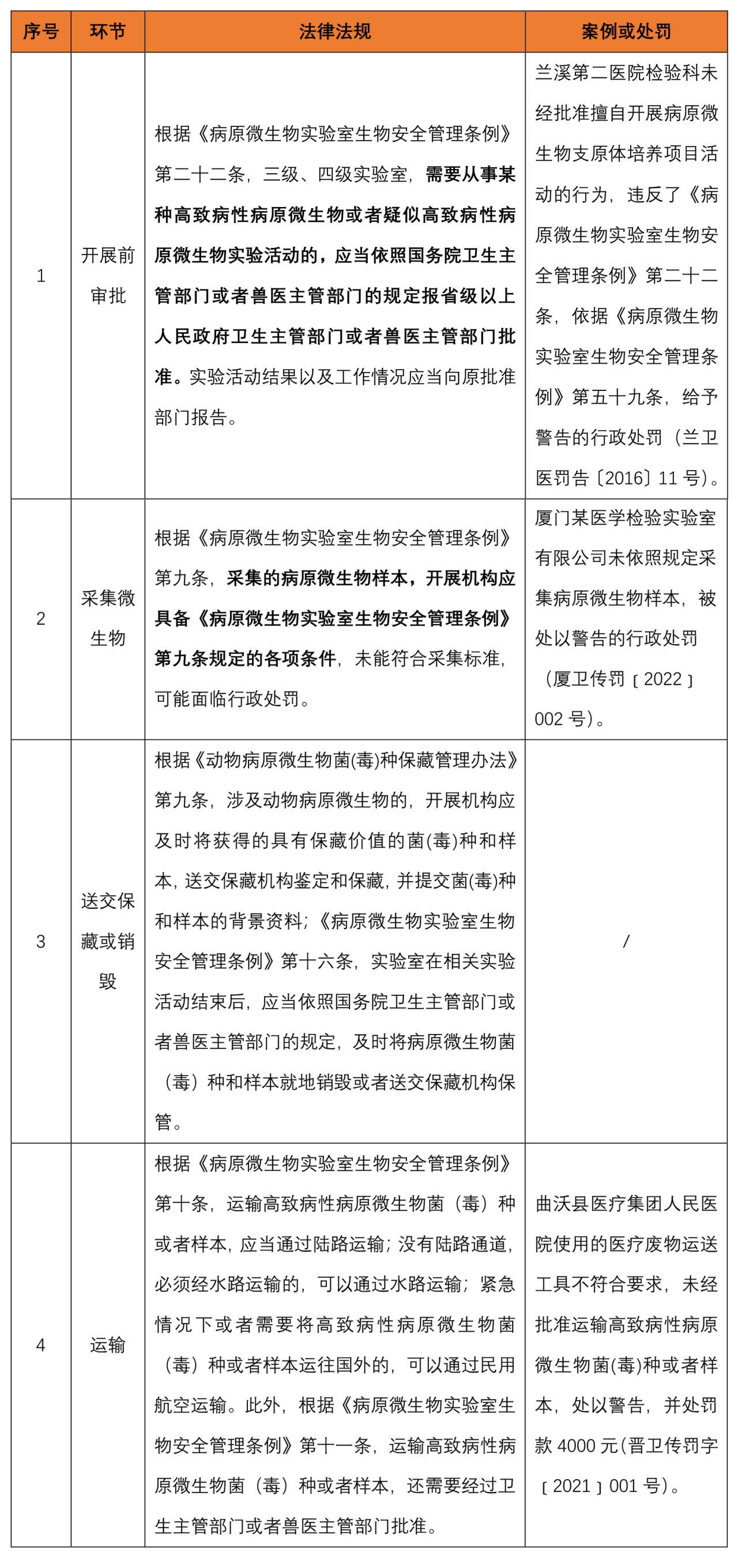
3. 实验人员操作合规
根据《病原微生物实验室生物安全管理条例》,与一般的实验相比,对实施病原微生物实验的工作人员的业务能力、合规意识、生物安全防护水平、健康状况等事项,法律法规采取了更严格的要求。根据《病原微生物实验室生物安全管理条例》第三十四条,开展机构应每年定期对工作人员进行培训,保证其掌握实验室技术规范、操作规程、生物安全防护知识和实际操作技能,并进行考核。工作人员经考核合格的,方可上岗。从事高致病性病原微生物相关实验活动的实验室应每半年将培训、考核其工作人员的情况和实验室运行情况向省级卫生主管部门或兽医主管部门报告。
实践中,亦存在病原微生物实验室的工作人员因操作不符合规范,而受到行政处罚的案例,如上海某生物医药有限公司的实验室工作人员未遵守实验室生物安全技术规范和操作规程被处以警告(金第2120225017号行政处罚书)。
4. 专利申请的保藏要求
如合成生物企业拟用微生物作为生物材料进行申请专利,则需要关注微生物的保藏要求。根据《专利法实施细则》第二十七条及《用于专利程序的生物材料保藏办法》,申请专利的发明涉及新的生物材料,该生物材料公众不能得到,并且对该生物材料的说明不足以使所属领域的技术人员实施其发明的,需将该生物材料的样品提交国务院专利行政部门认可的保藏单位保藏(即CGMCC、GDMCC和CCTCC)。
此外,值得注意的是,由于《布达佩斯条约》于1977年通过,根据《布达佩斯条约》,所有加入条约的国家必须承认在专利公开程序中向一个国际保藏单位保藏的微生物,不论保藏单位位于何处,即可满足向申请专利保护的其他国家单位交存微生物的要求。即在任意一个国际保藏单位完成保藏的微生物,可视为在其他缔约国也同步完成了保藏要求。中国是《布达佩斯条约》的成员国,即如企业需要使用微生物向国外进行专利申请,可关注《布达佩斯条约》的保藏要求以简化申请程序或材料。
5. 实验废物处置
依据《药物非临床研究质量管理规范》第十四条,研究机构应当具备收集和处置实验废弃物的设施;对不在研究机构内处置的废弃物,应当具备暂存或者转运的条件。除此之外,企业在处理涉及病原微生物产生的废物时,需要特别注意如下事项:
是否属于医疗废物:根据《医疗废物管理条例》第二条,医疗废物指医疗卫生机构在医疗、预防、保健以及其他相关活动中产生的具有直接或者间接感染性、毒性以及其他危害性的废物。根据《医疗废物分类目录》,携带病原微生物具有引发感染性疾病传播危险的医疗废物为感染性废物,需按照《医疗废物管理条例》进行处置。根据《医疗废物管理条例》,未能遵守医疗废物的处置规则,亦将面临行政处罚。如上海核子华曦医学检验实验室有限公司在运送过程中因丢弃医疗废物;在非贮存地点倾倒、堆放医疗废物或将医疗废物混入其他废物和生活垃圾,被处以警告,罚款人民币6000元(沪第2120225069号行政处罚书);
是否属于危险废物:根据《国家危险废物名录》,利用生物技术生产生物化学药品、基因工程药物过程中产生的蒸馏及反应残余物、废母液、反应基和培养基废物等物质[8]为HW02医药废物,属于危险废物,需要按《固体废物污染环境防治法》第六章危险废物进行处置。目前,我国对危险废物处置管理要求较为严格,实践中亦不乏因违反规定被处罚的案例,例如广州某单位因在经营过程中有实验废液、废微生物培养基、实验耗材、废样品、喷淋废水、废活性炭等危险废物产生,将该等危险废物委托给无危险废物经营许可证的单位收集、处置,导致被罚款人民币60万元(穗环(埔)法罚〔2023〕001号行政处罚书)。
四、总结
总体而言,合成生物企业所使用的微生物材料,从采购来源到废物处置,以及企业的主体资质和实验设备、工作人员,均存在相对应的合规要求,特别是对于高致病性病原微生物,目前的监管体制几乎涵盖了高致病性病原微生物研发过程的每个重要环节。
考虑到合成生物学仍是新兴行业,国家对其监管政策和行业自身的合规要求仍在不断完善之中,我们亦提示合成生物企业重视主营业务相关的合规要求,在制度的框架下对照自身情况做好合规工作,以避免监管风险及对未来上市或其他战略安排的影响,重视合规,方能行稳致远。
[注]
[1] Benner S A, Sismour A M. Synthetic biology. Nat Rev Genet, 2005, 6: 533–543
[2] 例如《两用物项和技术出口许可证管理目录》规定“三、生物两用品及相关设备和技术出口管制清单所列物项和技术"中的各项微生物病原体,属于需要办理两用物项和技术进出口许可证的范畴。
[3] 根据《动物病原微生物菌(毒)种保藏管理办法》,微生物保藏单位指,承担菌(毒)种和样本保藏任务,并向合法从事动物病原微生物相关活动的实验室或者兽用生物制品企业提供菌(毒)种或者样本的单位。
[4] 1977年开放加入的《国际承认用于专利程序的微生物保藏布达佩斯条约》,该条约的目的和宗旨是只要向任何一个条约承认“国际保藏单位"交存微生物,便足以在所有缔约国的国家专利局和任何(声明承认本条约效力的)区域性专利局办理专利程序。参见:https://www.wipo.int/treaties/zh/registration/budapest/summary_budapest.html
[5] 参见:http://cctcc.whu.edu.cn/portal/service_project/article/id/99/cid/21.html
[6] 参见:https://cgmcc.net/static/pdf/zyhly.pdf
[7] GDMCC虽暂未在其官网就商业化使用微生物作出严格限制,但如企业在购买微生物后拟用于商业化用途,我们亦建议提前与GDMCC进行沟通是否符合要求。
[8] 具体见《国家危险废物名录》中“HW02医药废物"的范围:https://www.mee.gov.cn/xxgk2018/xxgk/xxgk02/202011/W020201130399742157558.pdf









