医药代表新规或将重塑行业——《医药代表管理办法(征求意见稿)》的挑战及应对
医药代表新规或将重塑行业——《医药代表管理办法(征求意见稿)》的挑战及应对
2024年11月28日,国家药品监督管理局(下称“药监局”)综合司公开征求《医药代表管理办法(征求意见稿)》(下称“《管理办法征求意见稿》”)意见。一旦本次修订正式落地生效,外包医药代表团队将走向灭亡,过往合同销售组织(Contract Sales Organizations,下称“CSO”)的防火墙功能被大幅削弱,医药代表的准入门槛提高,并将面临全方位的监管围剿。这一变化对于药企原有的运营模式带来了巨大的挑战。
本文将结合(i)医药代表监管的历史背景,以及(ii)本次《管理办法征求意见稿》修订要点,为药企提示应对之策。
一、医药代表监管的历史背景
a.初期:舶来职业进入中国,监管方案初见雏形
改革开放初期,随着外资药企进入中国,医药代表这一舶来的职业群体也开始出现在各大药企中。2006年,《卫生部、国家中医药管理局关于建立健全防控医药购销领域商业贿赂长效机制的工作方案》中表示,对于医药代表这一舶来品,各级政府监管部门在学习和借鉴国外经验的同时,也需要针对不规范的营销行为进行监督管理和规范。[1]
此后10年间,医药代表的管理规定散落于国家和地方的各类文件中。有部分省市虽要求建立医药代表接待日制度[2],然而方案尚待完善,整体处于初步探索阶段。
b.变革:舆论聚焦回扣问题,药代进入备案时代
2016年底,央视CCTV-13新闻频道播报的一档《高回扣下的高药价》节目[3]中,记者调查发现:医院几乎每天都有上百个医药代表进入诊室、在医生的电脑上查询用药情况、对各个科室进行统方。报道指出,医药代表会根据医生的开药情况给予“信封”,“信封”中大约是药品价格35%左右的回扣。节目一经播出,医药代表这一群体被推上舆论的风口浪尖。
为打击医药代表的商业贿赂行为,2017年年初,国务院发布《关于进一步改革完善药品生产流通使用政策的若干意见》(业内称“医药国17条”),明确要求:“建立医药代表登记备案制度;医药代表只能从事学术推广、技术咨询等活动,不得承担药品销售任务。”
2017年至2020年的3年时间内,为落实医药国17条,国家药监局(原国家食品药品监督管理总局)先后发布了(i)《医药代表登记备案管理办法(试行)(征求意见稿)》(下称“《第一次征求意见》”),以及(ii)《医药代表备案管理办法(试行)(征求意见稿)》(下称“《第二次征求意见》”),并2次公开征求意见。最终2020年9月,《医药代表备案管理办法(试行)》(下称“《试行办法》”)正式出台。多地卫健委和公立医疗机构自此也逐步确立“三定两有”[4]等各类医药代表接待制度,严格核查医药代表的备案信息,防范违规推广行为。
c.升级:医药反腐风暴来袭,全面加强监管力度
2023年7月,国家卫生健康委员会(下称“卫健委”)等10部门启动了为期1年的医药反腐集中整治工作(业内称,医药反腐风暴)。大批医药代表由于商业贿赂等违法犯罪行为被采取刑事强制措施,多处学术会议一度宣布暂停、延期。
2024年5月,国家卫健委等14部门在《2024年纠正医药购销领域和医疗服务中不正之风工作要点》中,要求不断完善医药代表管理,加强对医药代表的管理。本次发布的《管理办法征求意见稿》中,也在4年前的《试行办法》基础上,升级了对医药代表的监督管理要求。监管部门对于腐败行为的加强打击,从中可见一斑。
二、《管理办法征求意见稿》修订要点
a.人员管理模式改变:外包淘汰,强制直聘
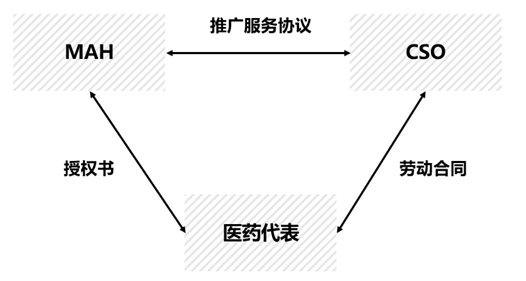
原《试行办法》下,药品上市许可持有人(Marketing Authorization Holder,下称“MAH”[5])可以选择(i)直接与医药代表签订劳动合同,或者(ii)与医药代表仅签订授权书。根据前述第(ii)种方案,药企获得了外包医药代表的空间:
(1)由CSO与医药代表签订劳动合同并管理人员;
(2)MAH与CSO签订推广服务协议,规定CSO提供推广服务时需配置的医药代表人员数量/工作量;以及
(3)MAH给予医药代表一份授权书,确保医药代表可以凭借有效授权开展推广工作。
具体见下图:
点击可查看大图
本次《管理办法征求意见稿》中则不再允许上述外包医药代表的做法。《管理办法征求意见稿》第9条规定:“MAH开展药品学术推广活动的,应当聘用医药代表。MAH应当与医药代表签订劳动合同和合规承诺书,医药代表违反合规承诺的,应当依法解除劳动合同。”医药代表备案的材料中,也不再是“劳动合同或授权书”二选一,两份材料必须一并提交。
也就是说,《管理办法征求意见稿》下,只有MAH直接雇佣、管理的医药代表才拥有合法推广的资格。目前受雇于CSO的医药代表将面临被淘汰或转型的命运。
b.医药代表门槛变高:重视专业,回归本质
2017年,《第一次征求意见》时就曾提出,医药代表必须(i)具备相关专业的大专(含高职)及以上学历,或(ii)具备其他专业的大专(含高职)以上学历,并具有2年以上医药领域工作经验。但该门槛在《第二次征求意见》发布时被删除。后续正式生效的《试行办法》中亦未采纳。
本次《管理办法征求意见稿》则提出了比《第一次征求意见》更高的门槛:医药代表必须(i)具有医药相关专业本科及以上学历(或者中级及以上专业技术职称),(ii)具有药品临床理论知识及实践经验,或者具有药品研发、生产、检验、质量管理等岗位工作经验,(iii)掌握所推广药品的知识,并且(iv)经MAH培训并考核合格。
这一要求旨在剔除医药代表职业群体中缺乏药品知识储备、轻技术、重销售的代表,促使医药代表回归其药品信息传递的本质。
c.药代登记制度确立:双重核验,严格管控
《试行办法》时代,国家层面仅强制要求医药代表在药监局指定的备案平台备案。但如果医疗机构仅靠备案平台公示信息核对医药代表的身份,可能会发生未备案人员冒用已备案医药代表身份信息进行推广的情况。因此,实践中多个省份曾发文,要求医药代表提供各类身份材料信息,供医院登记建档、核实身份。不过,这类文件适用的地域范围往往有限,通常仅对区域内的公立医院提出要求[6]。
本次《管理办法征求意见稿》从国家层面明确了强制性登记要求:医药代表不仅需要在备案平台备案,还需要在开展学术推广活动前向医疗机构登记,并向医疗机构提供(i)MAH法定代表人签字或盖章的授权书原件,(ii)医药代表身份证原件及复印件,以及(iii)备案信息表,以证明其身份。医疗机构及其工作人员只能与备案并登记的医药代表互动。如果医药代表提供的身份信息与备案信息不一致的,医疗机构不予接待。
d.七大部门联合监管:职责明晰,全面处罚
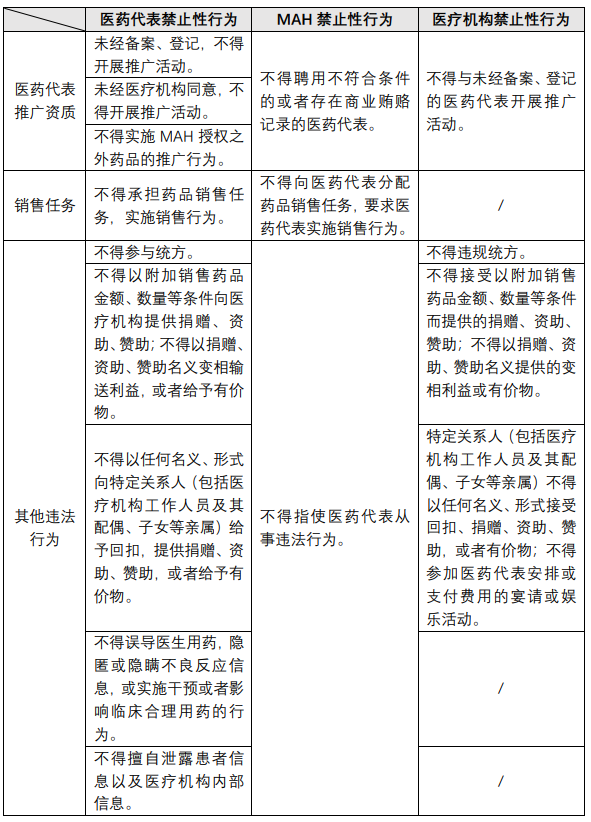
《管理办法征求意见稿》列出了MAH、医药代表以及医疗机构(及其工作人员)三方的禁止性行为,笔者简要总结如下:
点击可查看大图
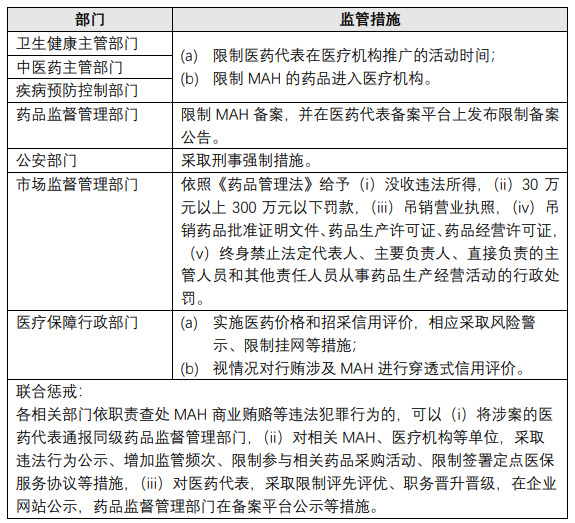
针对上述禁止性行为,本次《管理办法征求意见稿》还全方面加强了7个政府部门可采取的监管措施:
点击可查看大图
三、我们的建议
本次《管理办法征求意见稿》一旦生效,将对药企产生较大的影响。因此,我们建议药企提前准备应对方案,防止《管理办法征求意见稿》未来正式出台时措手不及:
1、梳理CSO推广协议,提早安排协议的变更或终止。按照《管理办法征求意见稿》的趋势,CSO未来能够承担的工作可能将仅限于制定推广方案、举办学术会议、制作拜访材料等,不再能承担与医生的互动沟通任务。
2、逐步缩减外包团队,聘用高质量医药代表。有些药企过往可能出于人员管理成本的考虑,完全外包医药代表,并无自有的医药代表团队。我们建议这类企业积极筹备资源,逐步配置高质量的自有团队。
3、构建完善的医药代表合规体系。例如,(i)明确医药代表的筛选和聘用标准及流程,(ii)落实登记与备案义务,(iii)对所有医药代表进行内部培训和考核,(iv)建立企业医药代表统一的标准拜访行为准则,(v)建立举报机制及内部惩戒措施等。
无论医药代表新规最终如何落地,都将给药企带来不小的挑战。药企只有提前做好规划和准备,尽早建立良好的合规体系,方能保障其长远稳健的运营!
[注]
[1] 《卫生部、国家中医药管理局关于建立健全防控医药购销领域商业贿赂长效机制的工作方案》(卫规财发〔2006〕471号):“学习和借鉴国外经验,针对我国医药代表不规范营销行为,有关部门要研究制订《医药代表营销行为规范》,做好医药代表的行为监督管理工作。”
[2] 广东省卫生厅《关于加强医院内部管理促进行风建设的意见》(粤卫〔2013〕56号):“建立医药企业人员院内活动规范管理制度,规定医药代表接待日制度和管理部门,医务人员不得私自与医药代表接触,及时对医药代表违规活动进行排查,落实违规医药企业不良记录制度。”
[3]https://tv.cctv.com/2016/12/24/VIDEBvQwrX5wyIheGf9Qugm4161224.shtml
[4] 一般指:定接待时间、定接待地点、定接待人员,有接待流程、有接待记录。
[5] 为免赘述,本文中指代的MAH包括境外MAH的境内代理人。
[6] 例如,《上海市医疗卫生机构接待医药生产经营企业管理规定》中,虽然规定了登记制度,但发文对象为上海市市级医疗机构;又如,陕西省卫健委发布的《医疗机构内医药代表接待管理规定(试行)》中,要求医疗机构应当指定专门部门为医药代表登记建档,但该文的发文对象为陕西省省内直委管各医疗机构。









