中国细胞与基因治疗行业(CGT)外商投资准入制度研究: 政策解构、行业影响与合规建议
中国细胞与基因治疗行业(CGT)外商投资准入制度研究: 政策解构、行业影响与合规建议
近年来,细胞与基因治疗(Cell and Gene Therapy, CGT)行业蓬勃发展,成为全球医疗健康产业的前沿领域。与此同时,中国CGT行业的外商投资准入政策经历了从空白到部分禁止、部分鼓励再到逐步开放的演变过程。2024年9月7日,商务部、国家卫生健康委、国家药监局联合发布《关于在医疗领域开展扩大开放试点工作的通知》,允许外商投资企业在北京、上海、广东、海南四地自由贸易试验区/自由贸易港有条件地从事人体干细胞、基因诊断与治疗技术开发和技术应用,标志着中国在CGT领域的对外开放迈出了重要一步,为国内CGT行业的发展注入了新的活力。本文拟从CGT行业概况出发,通过对中国CGT行业外商投资准入政策的系统梳理与解读,分析其对行业和企业发展的影响,进而提出切实可行的合规建议,助力中国CGT行业在全球舞台上实现高质量发展与突破。
一、CGT行业概述
细胞和基因治疗行业是依托于细胞治疗与基因治疗技术发展的医药领域新兴行业,相关技术能够以细胞和基因作为载体,通过对患者进行细胞治疗和基因治疗,直接对造成患者疾病的根源进行治疗,从而实现传统临床手段难以达成的治疗效果。广义的细胞和基因治疗包括细胞治疗和基因治疗[1],从我国CGT行业监管政策的角度来看,可进一步细分为细胞治疗、基因治疗和基因修饰细胞治疗,具体而言:
(一)细胞治疗
依据细胞类型和功能特点的不同,细胞治疗可细分为干细胞治疗、免疫细胞治疗和其他体细胞治疗。其中:(1)干细胞是一类具有自我更新和多向分化潜能的细胞,可以分化成多种类型的细胞,干细胞治疗主要利用干细胞的这些特性,通过移植健康的干细胞来修复受损的组织器官或替代病变细胞,从而达到治疗疾病的目的;目前全球获批的干细胞产品,绝大多数为造血干细胞和间充质干细胞产品;(2)免疫细胞是指参与免疫应答或与免疫应答有关的细胞,包括嵌合抗原受体T细胞(Chimeric 2Antigen Receptor T-Cell,CAR-T)、树突状细胞(DendriticCell,DC)、自然杀伤细胞(NK)、其他类型的T细胞(如TCR-T细胞)等;免疫细胞治疗通过采集自体或异体的免疫细胞,在体外进行培养、激活和扩增,使其数量和功能增强,再回输到患者体内,以增强机体的免疫能力,杀灭病原体和病变细胞;(3)其他体细胞治疗则通过特定的技术手段对例如神经细胞、骨骼细胞、胰岛细胞、肝细胞等其他类型的体细胞进行培养和移植,以修复受损的相应组织或器官。
(二)基因治疗
按照基因导入人体的方式不同,基因治疗可分为体内(in vivo)基因导入和体外(ex vivo)基因导入两种方式。体内基因治疗产品类型包括病毒载体类产品、核酸类产品、细菌载体类产品。体外基因修饰系统类型包括慢病毒、γ-逆转录病毒、腺病毒、腺相关病毒、仙台病毒等病毒载体类基因修饰系统,以及DNA、RNA、蛋白质和蛋白质-RNA复合物等非病毒载体类两类基因修饰系统。
(三)基因修饰细胞治疗
部分干细胞或免疫细胞治疗产品由于涉及基因编辑、修饰的技术路径,兼具了细胞治疗产品和基因治疗产品的特性,因此亦可称为基因修饰细胞治疗产品。根据《基因修饰细胞治疗产品非临床研究技术指导原则(试行)》,基因修饰细胞治疗产品是指经过基因修饰(如调节、替换、添加或删除等)以改变其生物学特性、拟用于治疗人类疾病的活细胞产品,如基因修饰的免疫细胞(如部分T细胞、NK细胞、树突状细胞和巨噬细胞等)、基因修饰的干细胞(如造血干细胞、多能诱导干细胞等)及其来源的细胞产品等。
根据《免疫细胞治疗产品药学研究与评价技术指导原则(试行)》的相关规定,对于经基因修饰的免疫细胞治疗产品(如CAR-T等),其细胞部分可以参考该指导原则,基因修饰部分可以参考其他相关技术指南。因此,若兼具干细胞/免疫细胞以及基因治疗产品属性,相关产品的研发需同时受限于干细胞/免疫细胞监管法律法规及技术指导原则以及基因修饰细胞治疗产品相关技术指导原则。
二、我国CGT行业外商投资准入政策的发展沿革
(一)政策空白阶段(2007年12月之前)
1995年6月,国家发展和改革委员会、对外贸易经济合作部、国家经济贸易委员会公布并实施《外商投资产业指导目录》,包括鼓励外商投资产业目录、限制外商投资产业目录和禁止外商投资产业目录三个部分。这是我国首次以法规形式对外公布鼓励、限制和禁止外商在华投资的产业领域,将外商投资与中国产业结构的调整相结合,被称为“正面清单”。
自“正面清单”发布以来,为适应国民经济社会发展和产业结构调整的需要,我国先后7次对《外商投资产业指导目录》进行修订。考虑到CGT行业在中国的发展进程,2007年12月之前修订并实施的《外商投资产业指导目录》均未提及CGT行业,CGT行业在外商投资准入方面处于政策空白阶段。
(二)部分禁止外商投资阶段(2007年12月至2019年)
2007年12月,《外商投资产业指导目录(2007年修订)》(已失效)正式施行,首次将“人体干细胞、基因诊断与治疗技术开发和应用”列入禁止外商投资产业目录。
2017年7月,国家发改委、商务部发布并施行《外商投资产业指导目录(2017年修订)》(已失效),该版本目录在结构设置上发生了较大变化,将鼓励类中对持股比例有要求的条目,以及限制类和禁止类这三类,统一整合成外商投资准入特别管理措施(外商投资准入负面清单),外商投资准入的负面清单初见雏形,“人体干细胞、基因诊断与治疗技术开发和应用”仍被列为禁止类。
2018年7月,国家发改委、商务部发布并施行《外商投资准入特别管理措施(负面清单)》(已失效)及《自由贸易试验区外商投资准入特别管理措施(负面清单)》(已失效),将外商投资准入负面清单从《外商投资产业指导目录》中独立出来,单独发布,并参照国际标准,以统一、透明的方式列明了持股比例要求、高管要求等特别管理措施。前述文件及后续更新发布版本(包括现行有效的《外商投资准入特别管理措施(负面清单)(2024年版)》)均明确“禁止外商投资人体干细胞、基因诊断与治疗技术开发和应用”。可见我国对于CGT行业中所涉人体干细胞、基因诊断与治疗技术开发和应用领域的监管政策一度采取严格谨慎的态度。
该阶段,我国外商投资准入政策对于CGT行业中除“人体干细胞、基因诊断与治疗技术开发和应用”之外的其他细分领域(如免疫细胞治疗等)未作规定,相关细分领域仍处于外商投资准入政策空白阶段。
(三)部分鼓励、开放试点阶段(2019年至今)
1、CGT部分领域被列为外资鼓励类
2021年1月,国家发改委、商务部发布并施行的《鼓励外商投资产业目录(2020年版)》(已失效)首次将“细胞治疗药物研发与生产(禁止外商投资领域除外)”列为外资鼓励类,现行有效的《鼓励外商投资产业目录(2022年版)》继续保留了这一条款。
2、扩大开放试点政策
自2019年以来,我国上海、北京、深圳、天津等多地监管部门发布文件,适度放宽外商投资干细胞及基因诊断与治疗技术开发与应用的政策限制,提议探索政策试点。
2024年2月28日,国务院办公厅发布《扎实推进高水平对外开放更大力度吸引和利用外资行动方案》,宣布放宽科技创新领域外商投资准入试点,允许北京、上海、广东等自由贸易试验区选择若干符合条件的外商投资企业在基因诊断与治疗技术开发和应用等领域进行扩大开放试点。2024年9月7日,商务部、国家卫生健康委、国家药监局印发《关于在医疗领域开展扩大开放试点工作的通知》(以下简称“《试点通知》”),指出拟在医疗领域开展扩大开放试点工作,在中国(北京)自由贸易试验区、中国(上海)自由贸易试验区、中国(广东)自由贸易试验区和海南自由贸易港允许外商投资企业从事人体干细胞、基因诊断与治疗技术开发和技术应用,以用于产品注册上市和生产。所有经过注册上市和批准生产的产品,可在全国范围使用。拟进行试点的外商投资企业应遵守我国相关法律、行政法规等规定,符合人类遗传资源管理、药品临床试验(含国际多中心临床试验)、药品注册上市、药品生产、伦理审查等规定要求,并履行相关管理程序。
3、扩大开放试点政策成效
2024年10月10日,注册地位于北京市北京经济技术开发区的北京康达行健科技发展有限公司完成营业执照变更,正式转型为港澳台投资企业,并在经营范围中新增了“人体干细胞技术开发和应用,人体基因诊断与治疗技术开发”等前沿领域,成为我国首例获批“人体干细胞技术开发和应用、人体基因诊断与治疗技术开发”执照的外商投资人体基因诊断与治疗技术企业。
2024年11月14日,默克检测(上海)有限公司、上海药明巨诺生物科技有限公司、原启生物科技(上海)有限责任公司、芳拓生物科技(上海)有限公司、星奕昂(上海)生物科技有限公司等6家外商投资企业,完成了在中国(上海)自由贸易试验区范围内开展人体干细胞和/或基因诊断与治疗技术开发和应用的外商投资企业营业执照经营范围变更工作。
三、我国CGT行业现行外商投资准入政策解读
如前文所述,我国CGT行业的外商投资准入政策经历了从空白到部分禁止、部分鼓励再到逐步开放、探索试点政策的演变过程。经检索,我国现行有效的外商投资准入政策中与CGT行业相关的内容具体如下表所示:
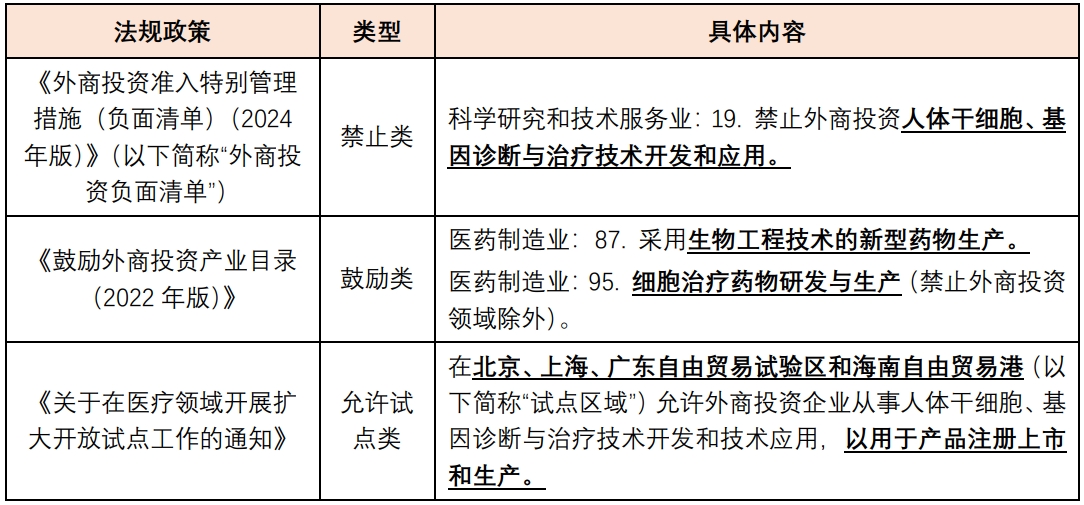
点击可查看大图
截至目前,我国法律法规、政策层面及相关主管部门并未对前述规定中“人体干细胞、基因诊断与治疗技术”的内涵和外延作出明确针对性解释。为进一步理解CGT行业落入外商投资负面清单的具体范围,下文将从“干细胞治疗”、“除干细胞外的其他细胞治疗”和“基因治疗”三个细分领域并结合相关法律法规规定和上市案例对前述政策进行解读:
(一)干细胞治疗
外商投资负面清单明确指出“禁止外商投资人体干细胞”,因此,人体干细胞的任何开发和应用均应落入外商投资负面清单范围,禁止在试点区域外开展外商投资。
经公开渠道检索,2020年以来,未发现有涉及干细胞领域相关业务的外商投资企业申报A股上市,相关外商投资企业的问询回复均为“不涉及外商投资负面清单所列业务领域”。相关上市审核问询要点及发行人回复要点具体如下:
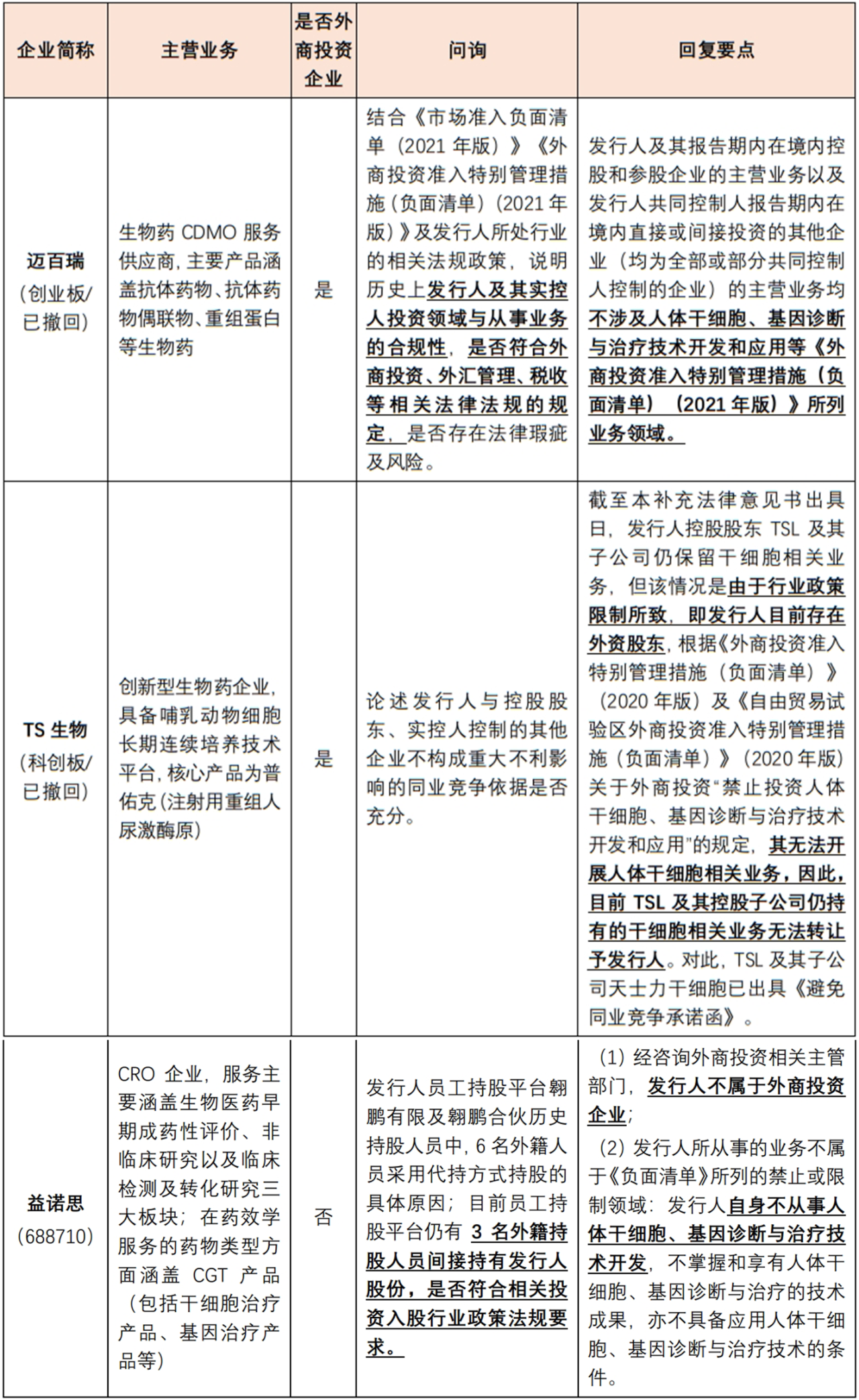
点击可查看大图
(二)除干细胞外的其他细胞治疗
对于不涉及基因治疗技术的免疫细胞治疗及其他体细胞治疗,不属于禁止外商投资的“人体干细胞、基因诊断与治疗技术开发和应用”领域,且相关产品按照我国药品管理相关法规进行研发和注册申报、不涉及基因治疗技术的,还可落入外商投资正面清单鼓励类的“细胞治疗药物研发与生产”。
对于涉及基因修饰及编辑技术的细胞治疗产品是否落入外商投资负面清单,在法规、政策层面未有定论。以CAR-T细胞治疗产品为例,CAR-T产品通过基因修饰技术对T细胞进行修饰,使其能够特异性识别并杀伤肿瘤细胞,其属于经过基因修饰的免疫细胞产品,兼具细胞治疗和基因治疗的特征。一方面,其可能落入外商投资负面清单禁止类的“基因诊断与治疗技术开发和应用”;另一方面,鉴于基因治疗技术亦属于生物工程技术,其亦可能落入外商投资正面清单鼓励类的“采用生物工程技术的新型药物生产”。
经查询,实践中,监管部门对于按照药物申报的CAR-T细胞治疗产品的外资准入采取认可的态度,我国境内已获国家药监局批准上市的CAR-T细胞治疗产品大部分由外商投资企业或其全资子公司作为上市许可持有人,包括上海药明巨诺生物科技有限公司(由香港公司JW(Hong Kong)Ther apeutics Limited持有100%股权)的瑞基奥仑赛注射液、恺兴生命科技(上海)有限公司(由香港公司CARsgen Pharma Holdings Limited持有100%股权)的泽沃基奥仑赛注射液、复星凯特生物科技有限公司(取得批件时由美国公司Kite Pharma,Inc.持有50%股权)的阿基仑赛注射液、南京驯鹿生物医药有限公司(外资持股比例超过30%)的伊基奥仑赛注射液。
经查询上市案例,涉及CAR-T等免疫细胞治疗业务的企业一般根据其经营业务的实际情况,通过论述其不属于外商投资企业或所从事业务因属于医药制造业、不属于科学研究和技术服务业进而不属于负面清单禁止类范畴,说明公司业务符合行业准入要求及外商投资政策。其中具有代表性的案例及论述要点如下:
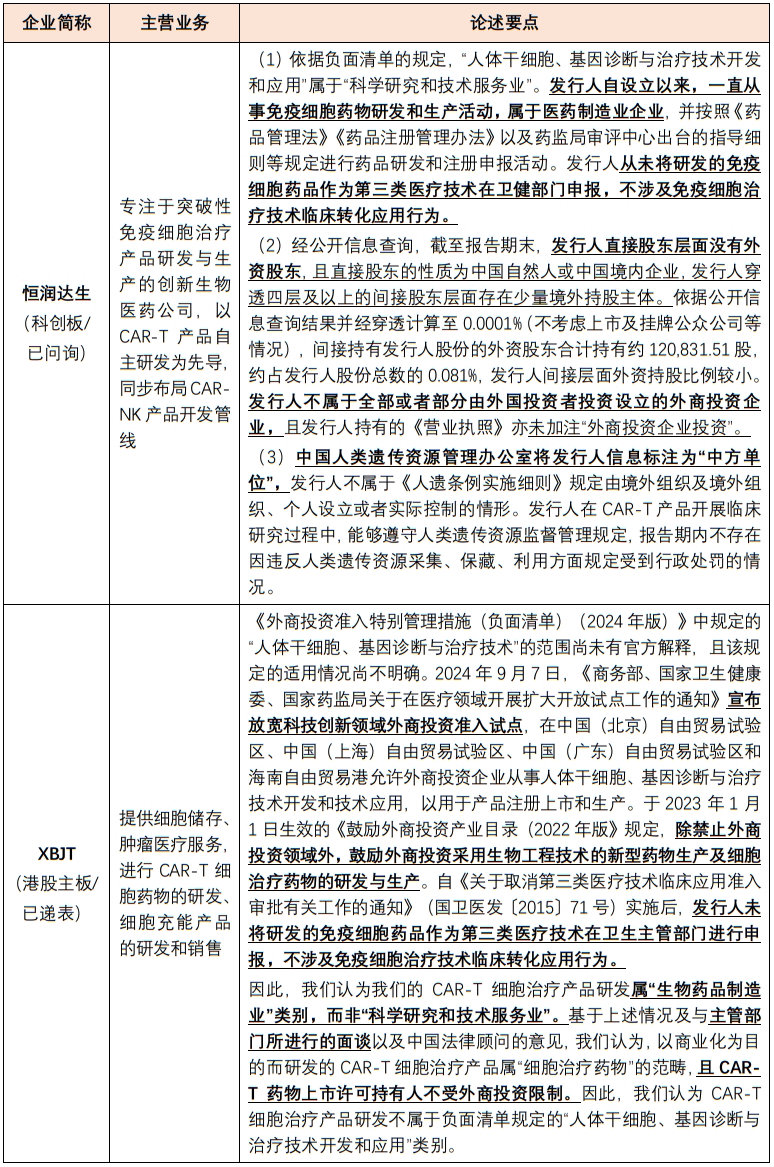
点击可查看大图
(三)基因治疗
针对基因治疗,“基因诊断与治疗技术的开发和应用”应落入外商投资负面清单范围。经公开渠道检索,2020年以来,未发现有涉及基因治疗领域相关业务的外商投资企业申报A股上市,相关外商投资企业的问询回复均为“不涉及外商投资负面清单所列业务领域”。相关上市审核问询要点及发行人回复要点具体如下:
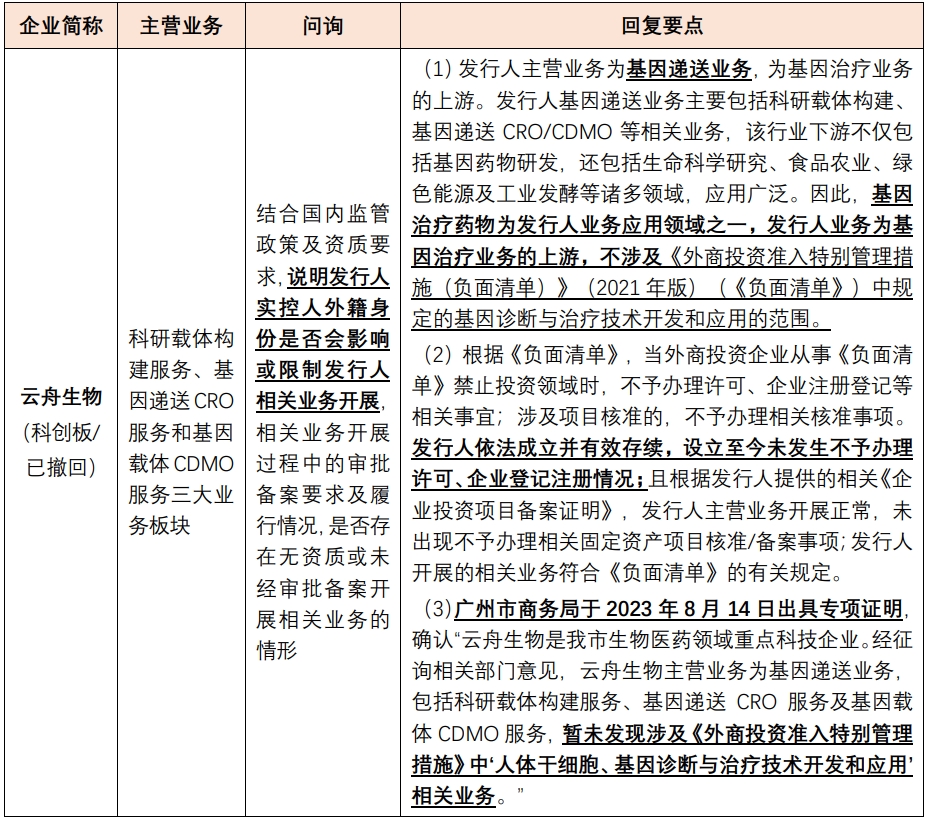
点击可查看大图
此外,区别于“基因诊断与治疗技术”,如企业仅从事基因检测或基因测序业务,未基于检测/测序报告进行进一步诊断、未得出临床诊疗结论,则不涉及基因诊断技术的研发及应用活动,相关企业不应落入外商投资负面清单范围。
四、外资开放对我国CGT行业及企业发展的多维影响及合规建议
(一)资本流动新格局:推动外资入场、拓宽企业融资渠道
正逢试点新政,外国投资者可获得投资中国干细胞及基因诊断与治疗产业的机会,国内生物医药公司则无需搭建VIE架构即可取得境外投资、深化国际合作,有利于进一步推动我国CGT上下游相关产业的发展。
建议国内CGT企业密切关注各地外资准入的开放情况,积极了解试点区域的政策动向,同步梳理集团内已注册实体的情况,考虑通过在试点区域新设关联公司、或将现有经营主体迁址至试点区域、或对集团内各公司业务定位进行调整等方式完善集团架构,以便更好地引入境外投资人。同时,建议CGT企业结合自身情况,评估不同外资参与方案的利弊,如直接引入外资、在试点区域与外资设立合资企业、进行并购交易、创新BD合作等形式,优化企业资本结构,选择最适合的发展路径。
(二)股权结构调整:通过VIE架构境外上市的适用性探讨
《试点通知》出台前,为规避外商投资负面清单的监管限制,实践中不少药企采用VIE架构从事人体干细胞、基因诊断与治疗技术开发和应用,存在境外投资人或境外融资架构的CGT企业则主要通过搭建VIE架构寻求境外上市。
在干细胞治疗领域,鉴于我国干细胞研发与商业化进程尚处于早期阶段,以干细胞为主营业务的企业基本为纯内资,因此未查询到具有直接参考意义的案例。在兼具免疫细胞治疗与基因治疗产品双重属性的CAR-T疗法领域,采用红筹架构申请境外上市的公司对于中国外商投资准入政策则存在不同理解:(1)鉴于实践中对“人体干细胞、基因诊断与治疗技术开发和应用”的具体解释尚缺乏较为明确的法律规定或监管指引,且部分企业申报上市时,“细胞治疗药物研发与生产(禁止外商投资领域除外)”尚未被列入外商投资鼓励类目录,包括科济药业(2171.HK)、药明巨诺(2126.HK)、永泰生物(6978.HK)在内的大部分公司出于谨慎或保守的考虑,认为其从事的CAR-T免疫细胞疗法业务落入或可能落入彼时《外商投资准入特别管理措施(负面清单)》禁止类范畴,因此搭建VIE架构;(2)个别公司认为彼时中国没有对人体干细胞以及基因诊断与治疗技术的官方法律从而未直接、明确披露其是否落入彼时负面清单范畴,例如亘喜生物(GRCL. O,纳斯达克上市,VIE架构,已被阿斯利康收购)等;(3)个别公司则在其招股书中通过结合公司实际经营情况和相关政府部门的确认明确其从事的CAR-T疗法研发符合国家外商投资产业政策的要求,如传奇生物(LEGN,纳斯达克上市,外商独资企业)等。
在《境内企业境外发行证券和上市管理试行办法》及相关适用指引(以下简称“境外上市新规”)出台前,小红筹架构模式境外上市受到的境内直接监管较少,实践中并没有明文规定要求企业在递交境外上市申请前或完成境外上市前履行境内申报或者审核程序。但在境外上市新规于2023年3月31日实施后,涉VIE架构企业的境外上市受限于证监会备案的特别核查要求以及集中问询。针对发行人存在协议控制架构安排情况的,《监管规则适用指引——境外发行上市类第2号:备案材料内容和格式指引》要求发行人境内律师就以下方面进行核查说明:(1)境外投资者参与发行人经营管理情况,例如派出董事等;(2)是否存在境内法律、行政法规和有关规定明确不得采用协议或合约安排控制业务、牌照、资质等的情形;(3)通过协议控制架构安排控制的境内运营主体是否属于外商投资安全审查范围,是否涉及外商投资限制或禁止领域。
考虑前述法规、政策环境的变化,一方面,境外上市新规出台、通过VIE架构进行境外上市的难度增加;另一方面,外商投资准入政策放宽,外国投资者可以合法合规地在境内直接投资CGT业务。因此,建议已经搭建红筹架构的CGT企业,可以根据创始人身份与国籍、研发与商业化进程、融资渠道、上市目的地的偏好等因素选择保留或者全部或部分拆除红筹架构、直接调整为外商独资企业(WFOE)或合资企业(Joint Venture)架构。
(三)人类遗传资源管理:国际合作中的合规要求
从事CGT业务可能涉及我国人类遗传资源的采集、保藏或出境。根据《中华人民共和国生物安全法》《中华人民共和国人类遗传资源管理条例》及《人类遗传资源管理条例实施细则》的相关规定,含有人体基因组、基因等遗传物质的器官、组织、细胞等遗传材料,以及利用人类遗传资源材料产生的数据等人类基因、基因组数据等信息资料(不包括临床数据、影像数据、蛋白质数据和代谢数据)均属于人类遗传资源;境外组织及境外组织、个人设立或者实际控制的机构(以下称外方单位)以及境外个人不得在我国境内采集、保藏我国人类遗传资源,不得向境外提供我国人类遗传资源;外方单位如需利用我国人类遗传资源开展科学研究活动的,需采取与我国科研机构、高等学校、医疗机构、企业合作的方式进行,并按规定申请行政许可或者备案。《试点通知》亦明确提到试点企业应遵守人类遗传资源监管要求,因此拟进行试点的外商投资企业若构成外方单位,应积极履行可能适用的国际合作科学研究等行政许可、备案、事先报告程序,搭建相应的合规制度体系(SOP)。
(四)研究者发起的CGT临床试验:外资参与的监管边界
根据发起主体和目的的不同,医药临床试验主要分为两种类型:研究者(通常是医生、科学家或学术机构)发起的临床试验(Investigator-Initiated Trial, IIT)和医药企业发起的药物临床试验(Industry-Sponsored Trial, IST)。与IST主要目的是支持产品的注册和上市不同,IIT通常旨在探索新的科学问题、验证新的假设或评估现有治疗方法的改进,不带有“产品注册上市和生产”的目的。
根据《试点通知》,外商投资被允许参与从事的CGT业务特别指明需满足“用于产品注册上市和生产”的目的。因此,为避免引发合规风险,建议相关企业在详细的实施规则出台之前,暂不引入外资资助及开展研究者发起的CGT临床试验,或在引入外资资助及开展研究者发起的CGT临床试验前主动与主管部门沟通,取得主管部门的明确回复意见,确保合规操作。
五、结语
企业发展需在政策支持、技术创新与合规管理之间寻求最佳平衡。随着《试点通知》的逐步落实和相关实施细则的不断完善,CGT行业的外商投资环境将更加优化,这亦对我国CGT行业监管体系建设和企业合规管控提出了更高要求,期望我国CGT行业在技术创新、市场拓展和国际合作等方面取得更大的突破,为全球医疗健康事业的发展做出更大的贡献。
[注]
[1] 该分类系参考弗若斯特沙利文咨询(中国)发布的《中国细胞与基因治疗产业发展白皮书》以及Frost & Sullivan发布的《Global Cell and Gene Therapy (CGT) Growth Opportunities》等咨询机构的行业研究报告和目前行业共识。










