从法律视角看制药业CMO/MAH模式如何落地
从法律视角看制药业CMO/MAH模式如何落地
近年来,中国的制药行业蓬勃发展,新业态层出不穷,比如药品研发领域的CRO模式,各种新药、检测试剂等制药相关产品也如雨后春笋,支撑着各类创新科技医药企业走上中国的资本市场。随着制药行业的不断发展和革新,药品生产领域也承待走入下一个时代。
制药业中的生产服务外包(Contract Manufacturing Organization,"CMO")模式,是指医药研发企业将药品生产委托给第三方,由接受委托的第三方药品生产企业生产,双方通过合同形式约定制剂生产、包装等专业化服务的药品生产模式。制药行业中,原料药、成品药和相关物料等都可以进行生产服务外包。CMO模式对于药品研发企业来说,可以解决其重资产投入的难题,令轻资产运行的药品研发企业和机构有机会在不自建药厂的前提下合法运营所开发药品。CMO模式的有效执行,必将大幅推进中国制药行业的进步。本文对CMO模式的探讨仅限于成品药的生产服务外包。
CMO模式以药品上市许可持有人(Marketing Authorization Holder,"MAH")制度为依托。MAH制度的核心在于药品上市许可与生产许可相分离,药品上市许可持有人可以委托第三方生产药品。在我国的制药行业实践中,有时在用语上也将CMO与MAH制度并用和交叉使用,均用于指代药品委托生产模式。
事实上,CMO/MAH模式在国际上已经实行多年。美国与欧盟一直以来实行CMO/MAH制度并逐步完善其监管,日本则在2005年正式引入了CMO/MAH制度。在这些具备成熟经验的国家和地区,目前CMO产业构架已趋于成熟,专业化 CMO 服务已经成为制药行业产业链的不可或缺的一环。
自2015年8月9日发布的《关于改革药品医疗器械审评审批制度的意见》(国发〔2015〕44号)提出开展MAH制度试点开始,中国监管部门就逐步对药品监管制度的改革展开探讨,并逐步形成法律、法规、制度,截止本文发稿之日,相关法律法规已经几近成型,但是还有若干处尚待明确以及完善。本文将结合我国MAH制度的基本框架,解读CMO模式。
中国制药行业概况
近年来,我国制药行业规模不断扩张,已逐步成为全球第二大制药国,以下数据[1]可以大致展现近年来中国制药市场的规模及发展态势:
|
项目 |
时间 |
数值 |
|
医药制造业规模以上工业企业营业收入 |
2017年 |
28459.6亿元人民币 |
|
2018年 |
24264.7亿元人民币 |
|
|
2019年 |
23908.6亿元人民币 |
|
|
医药制造业规模以上工业企业营业收入较上年增幅[2] |
2017年 |
12.5% |
|
2018年 |
12.4% |
|
|
2019年 |
7.4% |
|
|
医药制造业规模以上工业企业利润总额 |
2017年 |
3314.1亿元人民币 |
|
2018年 |
3094.2亿元人民币 |
|
|
2019年 |
3119.5亿元人民币 |
|
|
医药制造业规模以上工业企业利润总额较上年增幅 |
2017年 |
17.8% |
|
2018年 |
9.5% |
|
|
2019年 |
5.9% |
我们期待,在医药行业多种政策引导及市场需求增加等多重作用下,中国制药行业会继续保持稳定发展,并迎来产业转型升级及结构调整的机遇发展期。
MAH制度的落地
如前文所述,CMO模式的执行,以MAH制度落地为前提。
我国长期以来实行药品上市许可与生产相绑定的药品注册管理模式,药品注册批准文件颁发给该药品生产企业,由该药品生产企业负责药品生产和药品上市。
为提高新药研发积极性及药品生产资源的有效配置,我国自2015年起逐步试点MAH制度,并最终通过2019年12月1日起生效的《药品管理法》("新《药品管理法》")正式在全国范围内确立了该制度。在中国法项下,药品注册批准文件(也就是俗称的"药证")的持有人,即为药品上市许可的持有人,其可以选择自行生产该药品,也可以选择委托其他药品生产企业生产该药品。
-
(一)MAH制度下药品的生产与流通
在MAH制度下,药品上市许可持有人选择委托生产并委托销售的,药品在各参与主体之间的生产与流通大致如下图所示:
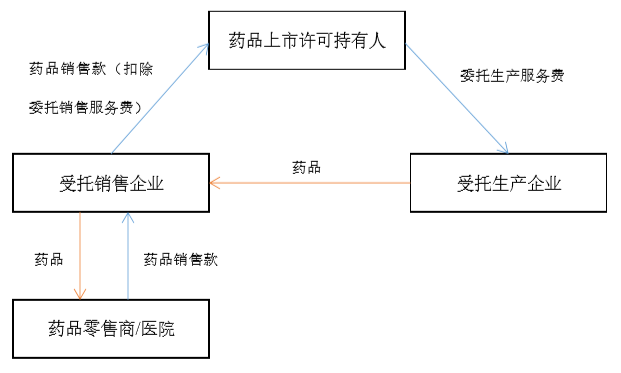
-
(二)持有人主体及其资质要求
新《药品管理法》规定企业或者药品研制机构等可以成为药品上市许可持有人,药品上市许可持有人应具有质量管理、风险防控和责任赔偿等能力。由此可见,新《药品管理法》对药品上市许可持有人的资质审核主要集中在质量控制和责任承担方面。因上市与生产相分离,药品上市许可持有人无需具有药品生产能力。
值得注意的是,根据新《药品管理法》,如药品上市许可持有人为境外企业,应当由其指定的在中国境内的企业法人履行药品上市许可持有人义务,与药品上市许可持有人承担连带责任。这一规则对境外药品上市许可持有人在风险保障方面提出了更严格的要求。对于境外药品上市许可持有人,可考虑指定其中国境内子公司或相关代理服务商,与其承担连带责任。
-
(三)药品上市许可的取得
MAH制度下,药品上市许可的取得包括原始取得和继受取得。申请人通过药品注册程序经批准获得药品注册证书后即自动成为药品上市许可持有人。药品上市后,药品上市许可也可经审批转让给符合药品上市许可持有人资质条件的受让方,该受让方也无需具有药品生产能力。
此前,由于药品上市与生产相绑定,国内已上市药品的"转让"主要通过《药品技术转让注册管理规定》("《技术转让规定》")规定的药品生产技术转让来实现,即受让方通过承接该药品的生产以获得药品注册批准文件。因受让方须为药品生产企业,且《技术转让规定》对于药品生产技术转让规定了相关条件限制(如未取得《新药证书》的品种,转让方与受让方须具有股权控制关系),通过该方式实现药品"转让"非常困难。实践中有些医药企业则通过股权收购的形式来最终控制药品生产企业的药品品种。但股权收购也存在承继被收购企业其他相关风险等问题,实践中运用有限。
由此可见,在MAH制度实施前,因制度所限,市场上药品上市许可的流转并不活跃。在MAH制度下,药品上市许可的转让不再与生产的变更相绑定,原则上符合药品上市许可持有人资质的受让方均可经审批获得药品上市许可。此后,药品上市许可的转让将更为灵活和规范化,结合CMO模式的运用,医药企业将具有更大的自由度进行商业安排。
MAH制度下CMO模式的实施
MAH制度实施之前,在注册生产捆绑的模式下,我国国内上市药领域的CMO模式运用有限,药品领域的CMO服务主要面向国际市场,为国际制药巨头境外上市药品提供药品生产等服务。就境内委托生产而言,根据《药品委托生产监督管理规定》,药品生产的委托方和受托方均应是持有GMP认证证书的药品生产企业,且CMO模式的开展仅限于"因技术改造暂不具备生产条件和能力或产能不足暂不能保障市场供应",此外委托生产还需取得省级食品药品监督管理部门颁发的《药品委托生产批件》。因此,在注册生产捆绑的制度下,CMO产业的发展面临许多限制,难以便捷地开展。
近年来改革药品委托生产监管模式的呼声日渐高涨,MAH制度确立后,与新的CMO模式相关的规则在MAH制度框架下也逐步完善。MAH制度下的CMO模式的相关规则梳理如下:
-
(一)受托生产企业的资质
对于药品生产企业的条件与资质,2020年3月30日发布的《药品生产监督管理办法》(注:该法尚待2020年7月1日起正式生效)第三条要求从事药品生产活动应"依法取得药品生产许可证,严格遵守药品生产质量管理规范,确保生产过程持续符合法定要求",第六条规定了取得药品生产许可证须满足的各项生产条件。由于新《药品管理法》取消了药品生产质量管理规范("GMP")认证而转为动态监管,受托生产企业无需再取得GMP认证,但其生产过程须全程满足GMP的要求。
因此,新《药品管理法》中的MAH制度下,受托生产企业所需满足的条件包括:1) 取得药品生产许可证;2) 生产过程全程满足GMP的要求。
-
(二)受托生产的药品范围
药品委托生产还应注意对于如下药品,存在相关药品委托生产的限制:
1、 血液制品、麻醉药品、精神药品、医疗用毒性药品、药品类易制毒化学品不得委托生产(国务院药品监督管理部门另有规定的除外)。
2、 经批准或者通过关联审评审批的原料药应当自行生产,不得再行委托他人生产。
3、超出疫苗生产能力确需委托生产的应当经国务院药品监督管理部门批准。
-
(三)受托生产企业登记及变更
根据2020年3月30日发布的《药品注册管理办法》(注:该法尚待2020年7月1日起正式生效),药品注册证书会同时载明药品上市许可持有人和生产企业信息,在药品注册申请阶段,药品审评中心会基于其对风险的评估决定是否启动药品注册生产现场核查。因此我们理解,药品生产企业登记为该药品的受托生产企业是在药品注册审批程序中同时进行的。
在药品注册上市后,药品上市许可持有人如需变更其所委托的生产企业,则应根据《药品注册管理办法》,履行相应的审批或备案手续。
-
(四)药品委托生产
CMO模式下,药品上市许可持有人与受托生产企业为委托服务关系。受托生产企业依照药品上市许可持有人要求以及GMP规范生产药品并收取委托生产费用,药品上市许可持有人进行严格的质量控制和监督管理。双方应根据其所订立的委托生产服务合同和质量控制合同等,对生产条件、生产标准和质量保证、产品提供及费用支付、知识产权等各方面安排进行约定。
-
(五)药品销售
在MAH制度实施前,药品生产企业可以自行销售其所生产的药品。
MAH制度下,药品上市许可持有人有权进行药品上市销售,但无论是药品上市许可持有人还是受托生产企业,除非符合药品经营的相关条件,均不具有自行销售的权利。根据新《药品管理法》,药品上市许可持有人如自行销售药品须具备药品经营条件,否则需要委托药品经营企业销售。因此,如药品上市许可持有人委托药品经营企业销售,则可约定受托生产企业将药品直接交付至指定的药品经营企业。
-
(六)跨境CMO
新《药品管理法》并没有禁止跨境进行药品委托生产。如果跨境CMO模式可行,这将给我国医药行业带来重大变化。在药品上市许可与生产许可相绑定的原制度下,如果境外企业拟在中国上市某种药品并在中国境内进行生产,则通常该药品须以国内药品生产企业的名义注册为国产药。而在MAH制度和跨境CMO模式下,境外企业或可直接持有药品注册证书并将药品委托中国的药品生产企业生产,而无需以国内药品生产企业名义进行药品注册。如果跨境委托生产可以实现,则一方面境外持有人可以委托中国药品生产企业生产国内上市药,另一方面国内持有人亦可委托境外药品生产企业生产国内上市药后进口至国内。
结语
MAH制度和CMO模式的实施是我国药品管理体系的重大改革和进步。随着MAH制度的落地,医药行业企业可以更为有效灵活地运用CMO模式。我们将持续关注相关法规修订进展,并期待中国医药行业企业可以有效利用制度红利,迎来新的业务发展和产业整合的机遇。
[注]
[1] 数据来源:国家统计局,http://www.stats.gov.cn
[2] 根据国家统计局说明,规模以上工业企业利润总额、营业收入等指标的增速均按可比口径计算。报告期数据与上年所公布的同指标数据之间有不可比因素,不能直接相比计算增速。
The End









