拨开迷雾见真章丨中药领域发明专利审查新规解读
拨开迷雾见真章丨中药领域发明专利审查新规解读
振兴中医药产业、促进中医药传承创新发展是党中央、国务院的重大决策部署。推动中医药传统知识保护与现代知识产权制度的有效衔接是我国建设知识产权强国的重要内容。2019年10月中共中央、国务院颁布的《关于促进中医药传承创新发展的意见》、同年11月印发的《关于强化知识产权保护的意见》、2022年12月最高院发布的《关于加强中医药知识产权司法保护的意见》均从不同角度强调要加强中医药产业知识产权保护和运用。
高质量的专利审查机制是高水平专利保护机制的基础一环。必须要注意的是,中药的理论基础和逻辑、中药复方的获得方式与西药不同,中药复方的药物组成成分、反应机理、药效作用机制更是极为复杂,甚至在当前的技术水平下尚无法明确。如何在可能是“一团迷雾"的技术方案中准确识别并把握发明点,如何合理审查并授予相关智力成果以专利权,实现专利权与公共利益之间的平衡,是常提常新的问题,也往往在实践中引发争议。
国家知识产权局曾于2020年4月发布《中药领域发明专利审查指导意见(征求意见稿)》(简称“中药审查意见征求意见稿"),其中对中药领域发明专利审查基准进行了诸多探索。但之后,该征求意见稿对应的正式文件迟迟未出炉,亦在一定程度上体现了相关标准在业界存在不小的争议。2023年12月21日,国家知识产权局公布了修订后的《专利审查指南》(简称“新审查指南"),引人注意的是,新审查指南第二部分新增第十一章,对中药领域发明专利申请审查进行了一系列专门规定。笔者拟结合实务经验,对相关规定进行全面解读。
一、关于哪些类型的中药成果可能被授予专利权
新审查指南区分产品和方法,正向列举了中药领域可被授予专利权的客体类型,具体如下表所示:

同时,新审查指南分别针对现行《专利法》第五条第一款[1]、第二十五条第一款[2],细化列举了不可授予专利权的申请。
首先,新审查指南明确规定“利用禁止入药的毒性中药材(例如关木通、广防己、青木香等)完成的发明"因会危害公众健康,妨害公共利益,违反《专利法》第五条第一款的规定,不能被授予专利权。
但是,新审查指南也没有将此类发明创造一概拒之于专利权门外,并规定经过炮制或配伍之后,如果有证据证明含该中药材的发明符合用药安全的,则可以被授予专利权。笔者认为,该但书具有合理性,因为使用毒性中药材的中药复方在炮制或配伍后整体上具有安全性是可能的,例如一种药物的毒烈之性可能被另一种药物减轻或消除。
值得注意的是,关于《专利法》第五条第一款的审查,中药审查意见征求意见稿还对涉及利用被禁止入药的稀有中药材完成的发明、涉及国家未禁止入药的毒性中药材的发明、原料药涉及“十八反"配伍禁忌的发明采取了“不授予专利权"或“原则上不授予,例外可以"的审查标准。笔者认为,虽然新审查指南中没有上述内容,但绝不意味着上述发明当然可被授予专利权。例如,如果某发明涉及配伍禁忌的中药组合物,且无证据证明其安全性,使用后会给公众造成危害,审查员依据审查指南第二部分第一章第3.1节“根据专利法第五条第一款不授予专利权的发明创造"等规定对其不授予专利权是完全可能的。
其次,新审查指南细化了《专利法》第二十五条第一款规定的不授予专利权的“科学发现"“智力活动的规则和方法"“疾病的诊断和治疗方法",具体如下表所示。
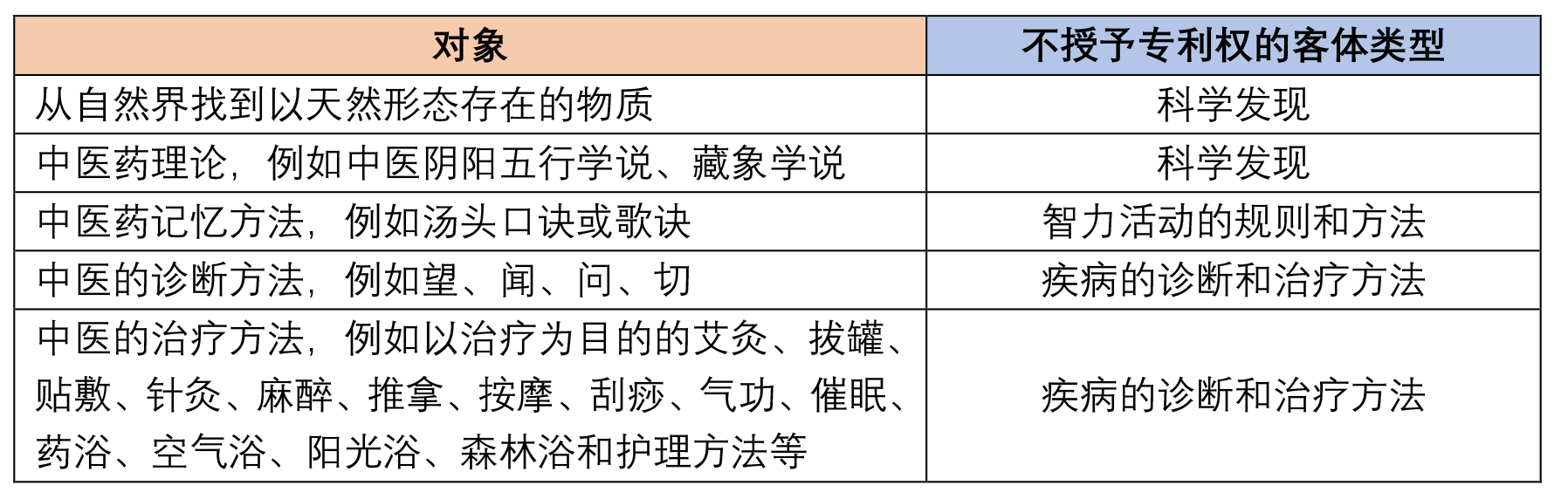
二、关于说明书的充分公开要求
首先,关于中药材名称。在中药领域,中药材的名称往往存在正名、异名、别名和俗称等形式。根据新审查指南,中药材名称充分公开的实质性标准是“足以使得本领域的技术人员能够确认该中药材的相关信息"。结合新审查指南的规定和示例,笔者提示,说明书中一般应记载中药材的正名,或使用在现有技术中有明确记载的中药材名称,最好还记载中药材的植物基原、拉丁名、药用部位、性味归经、功效等信息,避免指代不明确。
其次,关于中药组合物的组成及用量配比。中药讲究“配伍"。所谓“配伍",通俗而言即根据病情的需要和药物的特性,将不同的药物配合在一起使用。此处,配合显然意味着配伍并非药味的简单叠加。中药组方的原则最早见于《黄帝内经》,其中的《素问·至真要大论》指出,“主药之谓君,佐君之谓臣,应臣之谓使",即根据在方剂中的不同作用,将组成方剂的药物分为“君臣佐使"。一个方剂中各药味的用量配比关系通常决定了组合物的组方结构和主次作用,对疗效有直接影响。因此,对于中药组合物发明,说明书中不仅应当记载该中药组合物的中药原料组成,还应当记载各中药原料的用量配比关系,如采用重量份、重量比例、重量百分比等进行表述。
第三,关于中药组合物的医药用途。新审查指南明确规定,对于新的中药组合物,说明书中应当记载其具体的医药用途。此处,实践中讨论较多、争议较大的是提交实验数据的问题。
首先,不论中药审查意见征求意见稿还是新审查指南,均指出当本领域的技术人员根据现有技术无法预测发明能够实现所述医药用途(例如用于治疗中医的病或证)时,说明书还应当记载证明发明的技术方案可以解决预期要解决的技术问题或者达到预期的技术效果的实验数据。当然这也表示,未提交实验数据不必然导致说明书公开不充分。需要注意的是,对于“自组方发明"(未以已知方为基础,而是依据中医药理论和用药经验进行直接遣药组方或者改变了已知方的主要药味形成的组方发明)而言,说明书中除了需要记载发明的组方原则、组方结构或方解外,应当记载足以证明其技术效果的实验数据,以体现发明对现有技术作出的贡献。
其次,中药审查意见征求意见稿曾称“中药产品的技术效果通常需要通过药效学实验数据加以证实",虽然使用了“通常需要"措辞,但仍产生了不小的争议。究其原因,还是中医与西医的“理论体系"不同。西医以现代化学和生物学为基础,以病理、生理、生化表现与指标作为诊断和治疗依据,而中医以阴阳五行为基础,针对病人辨证论治。与此相一致,西药可以先通过细胞实验和动物实验明确有效成分、作用机制、治疗效果等,再在临床中予以应用,而中药的治疗效果则首先来自临床。因此,药效学实验数据可能“对病",但难以“对证",对有些证候的治疗效果也难以通过细胞实验或动物实验进行验证或说明。[3]目前,由《关于促进中医药传承创新发展的意见》、《中药注册管理专门规定》第六条可见,中药注册审评已采用中医药理论、人用经验和临床试验相结合的“综合评价模式"。对于专利申请中的实验数据,新审查指南指出可以是实验室实验(包括动物实验)数据,也可以是临床治疗效果数据(包括临床医案或临床病例),值得肯定。
笔者在此处希望提示的是,如果发明实际乃针对具体的证型,则专利申请人仅提及对应的“疾病"并提交治疗该疾病的试验数据是存在风险的。一方面说明书可能被认为公开不充分,另一方面也可能在审查新颖性或创造性时得到不利结论。笔者建议,如果某中药复方是针对具体的证型进行遣方用药的,应当记录组方过程、临床应用效果和经验。如进行动物实验,应当有针对性地构建该证型的动物实验模型。
三、关于中药领域发明的新颖性判断
与西医不同,中医乃沿着“理、法、方、药"的路径,针对病因病机进行诊断,进而“辨证施治"。针对不同的疾病,中医需根据病人的具体临床表现和症状,可将其分为不同的证型,例如胃食管反流病(GERD)可分为瘀血阻络证、胆热犯胃证、中虚气逆证等。在此基础上,中医将针对不同的证型,采用不同的治法,进而利用配伍关系将药物组织成方。同时,如新审查指南中指出的,中医的病或证与西医的病也不完全相对应。中医病名与西医病名即使相同,其所表述的实质疾病也不必然相同。
关于对专利法第二十二条第二款要求的新颖性的审查,中药审查意见征求意见稿中并未提及。新审查指南结合中医药“辨证论治"的基本原则和实务中的常见情形,给出了较为清晰的审查新颖性的指引:
(1)【证型与疾病】。如果发明涉及某中药的制药用途,其中所治疗的疾病以中医的病(例如胸痹)进行限定,而对比文件公开了该中药能够治疗某种证型的该疾病(例如气阴两虚型胸痹),由于以证型限定的中医疾病通常属于该疾病的一种类型,落在该疾病的范围内,故对比文件破坏发明的新颖性。
(2)【西医与中医】。如果发明涉及某中药的制药用途,其中所治疗的疾病以西医病名进行表述,而对比文件公开了该中药能够治疗一种以中医的病或证表述的相关疾病,如果对比文件与发明所涉及的疾病相同或实质相同,则破坏发明的新颖性。
此外,新审查指南还在本部分提示,对于涉及中药组合物组分用量配比的新颖性判断,当对比文件为中医古方时,由于历代度量衡多有变化,需要注意古方中用量单位的换算。
四、关于中药组合物发明的创造性判断
1、适用“三步法"判断中药组合物发明创造性的原则性规定
如何准确判断中药组合物的创造性可能是中药专利领域最受关注的问题。所谓发明具有创造性,是指与现有技术相比,该发明有突出的实质性特点和显著的进步。对于“突出的实质性特点",实践中通过《专利审查指南》第二部分第四章中的“三步法"审查发明相对于现有技术是否“非显而易见"。具体而言,第一步是“确定最接近的现有技术";第二步是“确定发明的区别特征和发明实际解决的技术问题";第三步是“判断要求保护的发明对本领域的技术人员来说是否显而易见"。
但是,在对中药组合物专利进行创造性判断时适用“三步法"并非易事。中药组合物的产生是先在临床上辨证施治后确定的,需经过多环节、多层次的考量,因而两个从文本上看药味大体相似的方剂,其所针对的证候和配伍的思路可能也不尽相同,甚至还可能截然相背。此外,中药组合物的各味药物并非简单叠加,而是通过复杂的作用机制相互协调,以共同实现整体药效的提升。实践中,审查员由于不了解中药组合物的成方过程,可能引用的所谓“最近的现有技术"实际上并无可比性,据此“机械地"审查下去显然难以得出准确结论。
在笔者看来,新审查指南关于中药领域发明专利申请审查的内容中最大的亮点是在该章第5.1节强调了中药组合物的特点、体现了中医诊治的逻辑、明确了适用“三步法"的具体要求。
(1)关于第一步。新审查指南要求考量发明与现有技术中组合物的“理、法、方、药",并从发明实质出发,分析组方结构,选择所属技术领域、所要解决的技术问题、技术效果或用途最接近,和/或起主要作用的中药原料(简称主要药味、主药或君药)相同或相近的现有技术。笔者认为,上述规定没有将重点放在“药味数量和药量"上,而是关注“理、法、方、药",重视现有技术的技术构思,包括所针对的证候、治法治则、“君臣佐使"配伍关系等,显然能够为下一步判断奠定良好基础。
(2)关于第二步。新审查指南沿袭中药审查意见征求意见稿,采用“分层分类"法确定区别特征,即可将区别药味按其在组方中发挥作用的主次地位进行分层,例如针对主病或主证的为主要药味,治疗兼证或次要症状的为次要药味;如果发明的组方结构不明晰,或者同一层级的中药原料较多,可将它们按功效或作用进行分类。但是,新审查指南此处并未进一步细化“确定发明实际解决的技术问题"的做法。笔者认为,技术问题需要根据区别特征所能达到的技术效果予以确定,在考察技术效果时不能仅关注最接近的现有技术未公开的药味的通常功效,而要看其在具体方剂中发挥的具体作用。
(3)关于第三步。根据新审查指南的表述,判断要求保护的中药组合物发明是否显而易见时的原则和逻辑与审查指南第二部分第四章第3.2.1.1节关于“三步法"中第三步的内容并无实质不同。不过,新审查指南明确列举了常见的技术启示来源,包括:最接近的现有技术的其他部分、教科书、工具书或综述性文献等现有技术中所公开的相关技术信息,例如药味的加减信息,药味的功效、用量用法和药理作用,以及发明所述疾病的病因病机、治法治则、常见病程变化和兼证等信息。
2、不同构思类型的中药组合物的发明创造性判断
新审查指南将中药组合物发明整体分为“加减方发明"和“自组方发明",其中加减方发明进一步分为中药原料变更的组方发明(以现有技术某一已知方为基础方,在不改变已知方主要药味的基础上,对次要药味和/或其药量进行调整而形成)和合方发明(将两个及以上的已知方合并使用或合方化裁而形成)。组方发明则进一步分为药味增减的发明、药味替换的发明、药量加减的发明。
对于中药原料变更的组方发明,根据新审查指南,如果现有技术没有给出将药味或药量变化等区别特征应用到基础方中以解决其存在的技术问题的技术启示,且发明产生了有益的技术效果,则发明具备创造性。反之,发明不具备创造性。具体如下表所示:

根据新审查指南,对于合方发明,通常需要考虑现有技术中是否存在组合的技术启示、组合的难易程度以及组合后的技术效果。对于自组方发明,通常需要在对组方原则和组方结构或方解进行分析的基础上,考量现有技术中是否存在将组方中各药味进行配伍以解决发明存在的技术问题的技术启示。对于合方发明和自组方发明,如果无技术启示且产生了有益的技术效果,则具备创造性。
3、实践中如何提高中药组合物发明的授权几率?
首先,研发中药组合物时应当重视技术构思,研究中药作用机理。笔者对于判断中药组合物创造性时脱离“三步法"、只要得到一个临床有效的处方就应当具备“非显而易见性"的观点持否定态度。新审查指南虽然对中药领域发明专利申请设立专章,但也没有脱离“三步法",且多处体现了对技术构思的重视。上述观点将导致研发人员在中药组合物的研发过程中更倾向于关注效果实现而非技术构思和机理探究,不仅可能导致申请专利时举步维艰,实际上也不利于中药组合物的创新发展。
其次,注意区分在外观上类似的“自组方"和“加减方"。在实践中,如果和现有技术相比,拟申请专利的中药组合物在外观上增加或减少了几个药味,药味的用量配比有所不同,在缺少其他信息(例如“君臣佐使"的确定过程)的情况下,审查员很容易视其为“加减方"。进而,审查员很容易认为该中药组合物属于“临证加减",产生的相关技术效果也是能够预料到的。
但是,在中医方剂学理论下,方剂中药物君、臣、佐、使的确定,主要是以药物针对病机的主次而在方中所起作用的主次为依据。每一方剂中的君、臣、佐、使是否齐备,全视具体病情及治疗要求,以及所选药物的功效来决定。至于方剂组成中君、臣、佐、使的药味多少与药量轻重,并无严格规定。[4]因此,上述中药组合物也可能是针对不同的证型,按照完全不同的技术构思和组方原则,重新排列了药味等级、层次和用量得到的,属于“自组方"而非“加减方"。
笔者建议,发明人注意保留相关研发记录、试验数据,并在申请专利时即将“自组方"相关信息有效传递给审查员,避免给审查员留下错误的第一印象。在审查员已经认为本申请仅是在现有技术的基础上调整药味得到的,技术效果也可以预见时,如果仅是泛泛地强调“需要配伍"“使用的原料、用量和配比恰到好处"“需要从众多的药味中挑选出合适的成份"等,往往难以使审查员的观念产生根本性扭转。此时,申请人可以考虑结合药味的增减、用量配比的细节信息,充分阐述本申请改变了已知方的主要药味,以将“自组方"区别于“加减方"。例如,在笔者办理的一个案件中,笔者除了指出本申请和对比文件记载的“君臣佐使"字面上不同外,还重点强调了本申请中的某一味药材作为君药,相比对比文件的用量是实质性减少的,而本领域技术人员通常不会尝试减少主要药味的用量等细节,最终说服了审查员。
第三,准确描述技术效果,及时、有效地提交试验数据。对于中医而言,辨证施治不可避免地包含主观性因素,中药组合物乃基于中医体系得到,各药物存在复杂的配伍关系。因此,申请人对于中药组合物的技术效果,尤其是组合物的协同增效、针对具体证候的效果描述,往往不准确或缺乏试验数据支撑,进而容易被视为“断言式"的技术效果。笔者建议,发明人应注意保留相关研发记录、实验室实验(包括动物实验)数据或临床治疗效果数据(包括临床医案或临床病例),并结合客观事实准确描述技术效果。如果拟在说明书中称本申请组合物具有协同增效作用,应当设计科学的、逻辑周延的比对试验、筛选试验等进行验证,结合实验数据和理论分析进行说明。
实践中,针对审查员检索出的最接近的现有技术,申请人在答复审查意见时可能需要进行补充试验并提交补充实验数据。虽然实践中补交实验数据的存在不被接受的风险,但是,根据司法实践[5]和实务经验,如果专利申请文件明确记载或者隐含公开了补充实验数据拟直接证明的技术效果,且公开了用于证明该效果的试验方法,而补充试验的试验方法、条件与专利申请文件公开的有关实验方法、条件一致,且补充试验数据在证据形式上具有真实性、合法性、关联性,则补充试验数据被采纳的可能性还是比较高的。
五、其他需要重视的规定
1、关于权利要求书的清楚和支持。根据新审查指南,中药组合物权利要求的表达方式适用第二部分第十章(关于化学领域发明专利申请审查的若干规定)第4.2.1节的规定,应当用组合物的组分或者组分和含量等组成特征来表征。此外,新审查指南明确,中药组合物权利要求可以采用“由……制成"这种以制备方法限定产品权利要求的表达方式。
同时,申请人应当在撰写权利要求时注意各药味的配伍关系与说明书中实质相同。如果权利要求概括的各中药原料的用量配比范围包含了与说明书公开的药味配伍关系实质不同的技术方案,导致本领域的技术人员根据说明书公开的内容不能预测权利要求的概括均能解决发明所要解决的技术问题并达到相同的技术效果,则存在权利要求得不到说明书支持的缺陷。
2、关于实用性。新审查指南指出了两种不具备实用性的情形:一是医生处方和医生对处方的调剂以及仅仅根据医生处方配药的过程;二是从动物体获取中药原料的方法,例如从活牛身体中摘取牛黄的方法、从活熊身体中获取熊胆汁的方法。
3、关于“诚实信用原则"条款。“诚实信用原则"是专利法第四次修改的亮点内容,与新审查指南同日发布的新实施细则第十一条落实了申请专利环节中的“诚实信用原则"。新审查指南第一部分第一章第7.9节进一步明确,对于专利申请是否符合“诚实信用原则"审查,适用《规范申请专利行为的规定》,当前即2023年12月21日公布的《规范申请专利行为的规定》(2023)(局令第77号)。
根据新实施细则,“诚实信用原则"的影响力贯穿专利申请初步审查、实质审查、复审、无效宣告程序。新实施细则和新审查指南生效后,审查员可以依据实施细则第十一条进行驳回处理或依职权宣告专利权无效,相关主体也可以依据本条提起无效宣告程序。因此,中药领域发明专利申请人应特别注意遵守诚信原则,避免出现编造发明创造内容、实验数据或者技术效果,简单替换、拼凑现有中药复方等情形。
结语
中医药是中华民族的伟大创造,是中国古代科学的瑰宝,也是打开中华文明宝库的钥匙,为中华民族繁衍生息作出了巨大贡献,对世界文明进步产生了积极影响。我国基于千百年来的中药理论传承和积累,在中药资源和知识层面具有天然优势。合理利用知识产权制度,将现代的专利制度与传统的中医药成果有效衔接,是促进中医药传承与开放创新发展的重要引擎。拨开迷雾见真章,新审查指南的出台无疑将使我国中药领域发明专利申请审查的思路更为清晰、结果更为准确,为我国中药质量的提升和产业高质量发展注入了一针催化剂。
[注]
[1] 《专利法》第五条 对违反法律、社会公德或者妨害公共利益的发明创造,不授予专利权。
对违反法律、行政法规的规定获取或者利用遗传资源,并依赖该遗传资源完成的发明创造,不授予专利权。
[2] 《专利法》第二十五条 对下列各项,不授予专利权:(一)科学发现;(二)智力活动的规则和方法;(三)疾病的诊断和治疗方法;(四)动物和植物品种;(五)原子核变换方法以及用原子核变换方法获得的物质;(六)对平面印刷品的图案、色彩或者二者的结合作出的主要起标识作用的设计。
对前款第(四)项所列产品的生产方法,可以依照本法规定授予专利权。
[3] 闫春辉, 刍议中药复方专利创造性判断中的那些“技术效果",载中伦视界公众号,2023年4月21日。
[4] 贾波、李冀主编,方剂学[M],中国中医药出版社,2014:10
[5] 参见:最高人民法院(2019)最高法知行终235号行政判决书、最高人民法院(2018)最高法行申3961号行政裁决书









