数字疗法系列文章(一):域外法观察
数字疗法系列文章(一):域外法观察
导语
随着科技的飞速发展,数字疗法正日益成为医疗领域的焦点。这一新兴领域的崛起,标志着医疗领域正朝着更智能、更个性化的方向迈进。数字疗法以先进的技术和数据分析为支撑,在健康管理和疾病预防方面展现出巨大潜力。然而,随之而来的挑战也是不可忽视的,法律监管方面的问题亟待解决。
本《数字疗法系列文章(一):域外法观察》将从数字疗法的定义、典型应用及域外监管实践出发,旨在为读者揭示这一领域的动态及关键问题。
一、什么是数字疗法
1、数字疗法的定义
目前各国对于数字疗法的界定尚未统一。2018年,国际数字疗法联盟(Digital Therapeutics Alliance, “DTA”)对数字疗法(Digital Therapeutics, DTx)及其产品的解释是:
“数字疗法将以患者为中心的技术与循证医学相结合,以提供高度个性化的护理。数字疗法产品向患者提供通过高质量软件程序驱动的直接治疗性干预,以预防、管理或治疗医学问题或疾病。数字疗法产品融合了先进技术的最佳实践,并根据要求由监管机构进行验证,以支持产品中有关风险、功效和预期用途的声明。”[1](“2018年数字疗法定义”)
2020年,DTA表示,虽然上述2018年数字疗法定义已经反映了数字疗法生态系统中大部分产品,但为了更清楚地说明(i)数字疗法与数字医疗技术(Digital Health Technology, DHT)[2]的区别,以及(ii)数字疗法与医疗器械的关系,DTA邀请了国际标准化组织(“ISO”)重新正式定义“数字疗法”。
2023年6月,ISO在《健康信息学-个性化数字健康-数字治疗健康软件系统》(“ISO/TR 11147”)中对“数字疗法”进行了重新定义,并被DTA同步采纳:
“数字疗法是指,通过生成和提供对患者健康具有明显积极治疗影响的医学干预,旨在治疗或缓解疾病、紊乱、病况或损伤的健康软件。”[3](“2023年数字疗法定义”)
2、数字疗法与数字医疗技术的区别
国际上目前也没有统一的对于“数字医疗技术”范围的界定。根据DTA的观点,数字医疗技术包含的范围非常广,包括:(i)企业系统和支持产品,(ii)诊疗服务工具及其支持工具,(iii)面向患者的保健产品及其支持产品,(iv)面向患者的诊断及监测工具,(v)面向患者的治疗干预产品。
同时,DTA进一步表态认为,数字疗法属于数字医疗技术中“(v)面向患者的治疗干预产品”中的一类子类。且DTA认为,数字疗法应同时具备作为医疗器械子类的资格。
总结而言,数字医疗技术与数字疗法的关系如下图所示:

图1 数字医疗技术与数字疗法的关系(*参考ISO/TR 11147)
3、数字疗法与医疗器械的关系
a.无治疗干预功能的医疗器械:不属于数字疗法
如上文中图1所示,虽然数字疗法都属于医疗器械,但并非所有看起来“数字化”的医疗器械都是数字疗法:
(1)医疗器械的范围相对更广。以美国食品药品监督管理局(United States Food and Drug Administration, “FDA”)对医疗器械的定义为例,医疗器械可以是仪器、设备、器具、机器、用具、植入物、体外试剂,或者其他类似或相关物品,包含任何组件、零件或附件。医疗器械的目的可能包括疾病的诊断、治疗、减轻、缓解、预防、生理结构或者生理功能的影响等。
(2)数字疗法则必须是健康软件,且其目的较为单一,仅限于为治疗、缓解之目的。为免疑义,DTA在注释中强调,管理、改变、康复和减缓疾病或病程进展都包括在前述“治疗、缓解”一词的含义中。但对于尚未存在且无可疑情况的疾病、紊乱、病况或损伤的预防,不属于此列。
ISO表示,其在定义“数字疗法”时,特地删除了医疗器械的目的中不具有“治疗性”的词汇。也就是说,医学影像诊断设备(例如CT、MRI设备)中的软件,虽然可能属于医疗器械的一部分,但由于其并不能直接干预、治疗或缓解疾病,可能并不属于数字疗法。
b.医疗器械中的软件(Software in a Medical Device, “SiMD”):往往不属于数字疗法
为了进一步说明哪些医疗器械属于数字疗法,ISO列出了两类最可能与数字疗法相关的医疗器械子类别:(i)医疗器械中的软件(Software in a Medical Device, “SiMD”),以及(ii)作为医疗器械的软件(Software as a Medical Device, “SaMD”)。
SaMD软件本身可以独立作为医疗器械,也可以与其他医疗器械(甚至是非医疗器械的通用硬件,如VR头戴设备、手表等)相结合进行使用,更重要的是,SaMD无需成为硬件医疗器械的一部分即可执行一个或多个医疗目的。而SiMD不同,SiMD必须作为某个硬件医疗器械的组成部分使用,用于驱动硬件医疗器械。ISO正是考虑到,SiMD的预期目的往往是用于驱动硬件医疗器械而非对患者的健康产生医学干预,故认为SiMD往往不属于数字疗法。
ISO进一步认为,一般情况下,数字疗法属于SaMD类的医疗器械。根据ISO/TR 11147,SaMD、SiMD、及医疗器械的关系如下图所示:
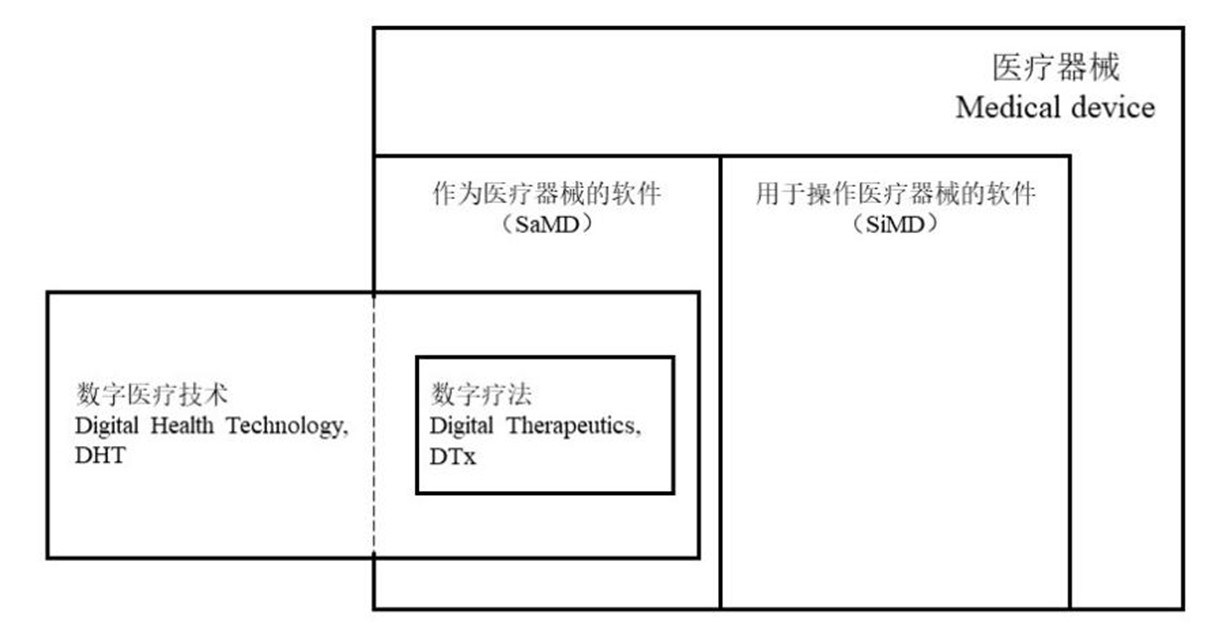
图2 数字疗法与SaMD、SiMD、及医疗器械的关系
(*参考ISO/TR 11147)
二、数字疗法的典型应用
DTA按照功能与作用方式,将数字疗法分为3类[4]:
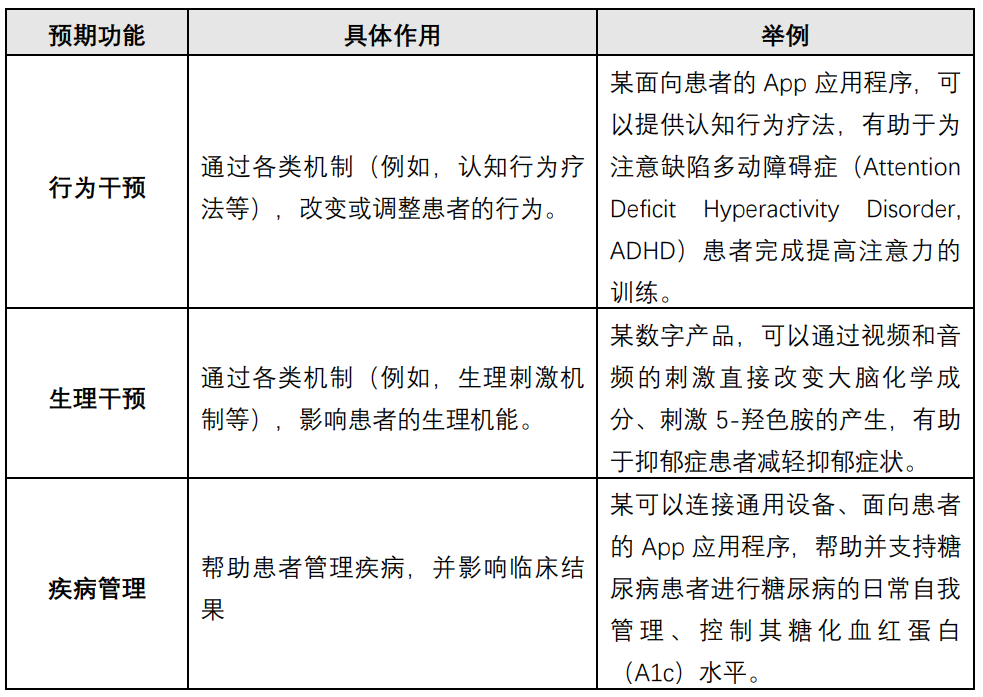
点击可查看大图
三、域外对数字疗法的监管路径
目前,大多数国家均将数字疗法纳入传统医疗器械的监管路径进行监管,与此同时,一些国家已经在探索专门针对数字疗法的法规框架,以规范数字疗法产品的开发、上市和使用。
2017年,当时的美国FDA局长Scott Gottlieb表示,“FDA过去面临的困难在于,如何使用传统的医疗器械审查方法来最好地监管这些非传统的医疗工具。我们设想并寻求通过‘软件预认证试点’来开发一种新的、务实的(监管)数字医疗技术的方法。我们的方法必须认识到数字医疗技术的独特特征和这些工具的市场,这样我们才能继续推动高质量、安全和有效的数字医疗设备的创新。”
自此,美国FDA启动了一项“软件预认证试点”项目(“试点项目”),试图探索专门适用于SaMD(包括数字疗法)的监管制度框架,以区别于美国FDA传统的医疗器械准入监管制度。试点项目于2022年9月宣布结项。
1、FDA传统医疗器械准入监管制度
传统医疗器械向FDA申请上市的,一般需要经过4个步骤。
a.步骤1:医疗器械分类界定。FDA根据医疗器械对患者造成的潜在风险,将医疗器械分为三个类别:I类(低风险)、II类(中等风险)和III类(高风险)。申请人可以根据FDA提供的分类数据库等工具自行判断其拟上市的医疗器械属于哪一类别。申请人也可以向FDA提交请求,由FDA作出官方的医疗器械分类界定。
b.步骤2:预上市申请(Premarket Submission)。在美国法律框架下,不同类别的医疗器械,需要进行的预上市申请流程不同。申请人需要根据步骤1中界定的医疗器械类别,确定所适用的预上市申请流程。
1)I类、II类医疗器械
a)510(k)[5]申请:一般而言,I类和II类医疗器械需要通过510(k)申请进行预上市申请。510(k)申请下,申请人必须将其医疗器械与一种或多种类似的已上市医疗器械(“参照产品”)进行比较,证明其医疗器械在安全性和有效性方面与既有参照产品实质等同(substantially equivalent)[6]。
b)De Novo[7]请求:如果申请人的医疗器械(i)经提交510(k)申请后,收到了“非实质等同(not substantially equivalent, NSE)”的决定,或(ii)申请人未提交510(k)申请,但自我评估后认为没有合适的参照产品进行比较的,则可以向FDA提交De Novo请求。
c)豁免:部分I类和少部分II类医疗器械可以被豁免预上市申请的要求,FDA以清单形式列明了具体的豁免列表[8]。
2)III类
a)预上市许可(Premarket Approval, “PMA”)途径:如果产品被归类为第III类医疗器械的,则需经过PMA途径才能上市销售。 PMA途径适用于高风险的医疗器械,审批程序更加严格,所需的证据要求也更高。
b)人道主义器械豁免(Humanitarian Device Exemption,“HDE”)途径:如果第III类医疗器械将用于使罕见病患者获益,且获得了人道主义使用器械(Humanitarian Use Device,“HUD”)的批准,则可以申请HDE豁免途径。
c.步骤3:提交预上市申请材料、与FDA官员互动并接受审查。
申请人确定医疗器械所适用的预上市申请流程后,可以准备材料并向FDA提交。FDA收到材料后,将会对医疗器械进行(i)行政审查,以评估申请人提交的申请材料是否足够完整,以及(ii)实质审查。审查期间,FDA官员将与申请人进行互动沟通,以提高审查的效率。
d.步骤4:获得上市批准(如适用)、注册医疗器械、上市并遵守适用的监管要求。
无论是I类、II类或III类的医疗器械,获得FDA对于预上市申请的批准后(如适用),需要注册医疗器械并上市,并均需要遵守多个“一般监管要求”,包括但不限于:(i)生产符合良好生产规范的医疗器械,(ii)根据标签相关规定为医疗器械贴标签,以及(iii)不得掺假等。此外,根据医疗器械类别的不同,还可能需要遵守不同的特殊监管要求。
2、试点项目对数字疗法的监管制度
在试点项目进行了1年多后,2019年1月,FDA决定,所有试点产品均首先参考适用传统医疗器械中的De Novo请求审批流程。待出现参照产品后,其他在试点项目中的产品再参考适用传统的510(k)途径。这一决定可能也从侧面说明了大多数数字疗法的创新性以及中/低风险性。参与试点项目的医疗器械上市前需要经过如下4个步骤:(i)卓越评估(Excellence Appraisal),(ii)审查决定预申请(Review Determination Pre-submission),(iii)精简审查(Streamlined Review),以及(iv)真实世界表现(Real-world Performance)。
a.卓越评估(Excellence Appraisal)
卓越评估的步骤是为了替代传统医疗器械“提交预上市申请材料”这一步骤。在试点项目结项后,FDA在项目总结中认为,卓越评估环节需要考虑5个卓越原则(Excellence Principles)和12个要素(Elements)。
(1)5个卓越原则为:(i)患者安全,(ii)产品质量,(iii)临床责任,(iv)网络安全责任,以及(v)积极进取的文化。
(2)12个要素包括:(i)领导及组织的支持,(ii)透明度,(iii)人力,(iv)基础设施和工作环境,(v)风险管理,(vi)配置管理与变更控制,(vii)规程与产品的测量、分析和持续更新,(viii)外包规程、活动和产品的管理,(ix)需求管理,(x)软件的设计与开发,(xi)软件的验证与确认,以及(xii)部署与维护。
根据笔者的观察,虽然(i)传统医疗器械提交的预上市申请材料,和(ii)数字疗法卓越评估中提交的材料,两者的目的都是为了证明医疗器械的安全性和有效性,但FDA针对数字疗法的特性,对卓越评估需提交的材料进行了不小的调整。例如,数字疗法中涉及的软件需要医疗器械公司持续维护,且往往软件的修复、更新与迭代比传统医疗器械的迭代速度要迅速许多,这将十分考验医疗器械公司在软件方面的能力。也因此,在卓越评估中,FDA考虑了很多关于软件设计、开发、更新相关的要素。
b.审查决定预申请
通过卓越评估后,申请人可以选择是否提交“审查决定预申请”。在该流程中,申请人可以与FDA沟通其产品的情况,确认产品是否符合De Novo/510(k)审批中对产品的审核要求。这一步骤类似于传统医疗器械中“提交预上市申请材料”后“与FDA官员互动”的步骤。
c.精简审查
考虑到SaMD(包括数字疗法)在此前已经过卓越评估,且相关软件的表现可以在之后的真实世界表现中进行监测,FDA在试点项目中给予了试点产品精简审查的优待。相比于传统医疗器械的准入监管审查程序而言,精简审查总体审批流程更短,可以使申请人的医疗器械产品更快地上市。
d.真实世界表现
FDA认为,良好的申请人不仅需要在开发产品阶段保证产品质量,在产品上市后也应保持监测、从产品在真实世界中的应用情况以及数据中汲取经验。传统医疗器械上市后,更多的是被动地“遵守监管要求”,而数字疗法上市后,则需要主动与FDA分享数字疗法在真实世界中的表现:FDA要求试点项目中的所有申请人,在符合数据法律法规要求的框架下,收集并分析产品的真实世界表现数据,并允许FDA对相关数据拥有访问权限。同时,医疗器械公司还需要向FDA保证,其在真实世界表现中收集并处理数据的行为符合法律法规的要求。
结语
虽然目前全世界的法律法规尚无成熟的针对数字疗法的监管体系,但从美国为期5年的试点项目中可以发现,很多国家的监管部门都意识到了数字疗法与传统医疗器械需要的监管体系不尽然相同。笔者也非常期待,在数字疗法领域不断崛起技术革命的同时,无论是域外还是中国,可以建立专门针对数字疗法的成熟监管框架,确保数字疗法能够在合规的框架下发挥潜力,建设一个更加健康智能的医疗未来。
[注]
[1] “Digital therapeutics (DTx) combine patient-centric technologies with evidence-based medicine to deliver highly personalized care. DTx products deliver direct therapeutic interventions to patients that are driven by high quality software programs to prevent, manage, or treat a medical disorder or disease. They incorporate advanced technology best practices and are validated by regulatory bodies as required to support product claims regarding risk, efficacy, and intended use.”https://dtxalliance.org/2018/10/23/dtaindustryreport2018/
[2] 国际数字疗法联盟举例的数字医疗产品如:保健、临床决策支持、监测、诊断。
[3] “Digital therapeutics are health softwares intended to treat or alleviate a disease, disorder, condition, or injury by generating and delivering a medical intervention that has a demonstrable positive therapeutic impact on a patient’s health.” https://dtxalliance.org/wp-content/uploads/2023/06/DTA_FS_ISO-Definition.pdf
[4] https://dtxalliance.org/wp-content/uploads/2023/06/DTA_FS_DTx-Intended-Uses.pdf
[5] 在1950年代,美国国会通过了一项法案,即《联邦食品、药品和化妆品法》(Federal Food, Drug, and Cosmetic Act)。该法案的第510(k)条要求必须注册的器械制造商至少提前90天将其销售医疗器械的意图通知FDA。后来,这项程序成为了医疗器械市场准入的重要流程之一,并被称为“510(k)申请”。
[6] https://www.fda.gov/medical-devices/premarket-submissions-selecting-and-preparing-correct-submission/premarket-notification-510k
[7] 在拉丁语中,“de novo”意味着“从新开始”或“重新”。
[8] https://www.accessdata.fda.gov/scripts/cdrh/cfdocs/cfpcd/315.cfm









